题目内容
17.下列说法正确的是( )| A. | 在相同温度下,饱和溶液一定比不饱和溶液导电性强 | |
| B. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| C. | 晶体NaCl不导电,所以它不是电解质,而铜、铁等金属能导电,所以它们是电解质 | |
| D. | 氯化氢溶于水能导电,但液态氯化氢不导电 |
分析 A.溶液导电性强弱与离子浓度成正比,与是否是饱和溶液无关;
B.氯化钠在水分子的作用下电离出氢离子和氯离子;
C.含有自由移动离子或电子的物质能导电,在水溶液里或熔融状态下能导电的化合物是电解质;
D.含有自由移动离子或电子的物质能导电.
解答 解:A.溶液导电性强弱与离子浓度成正比,与是否是饱和溶液无关,所以饱和溶液的导电能力不一定强于不饱和溶液,如AgCl饱和溶液导电能力小于氨水溶液,故A错误;
B.氯化钠在水分子的作用下电离出氢离子和氯离子,不需要通电,故B错误;
C.含有自由移动离子或电子的物质能导电,在水溶液里或熔融状态下能导电的化合物是电解质,氯化钠固体中不含自由移动离子,所以固体氯化钠不导电,但氯化钠是电解质,Cu、Fe等金属单质中含有自由移动电子,所以能导电,故C错误;
D.含有自由移动离子或电子的物质能导电,HCl溶于水后电离出自由移动离子而使氯化氢水溶液导电,但HCl中只含分子,所以液态HCl不导电,故D正确;
故选D.
点评 本题考查物质与导电的关系,侧重考查学生对电解质、非电解质、溶液导电性之间的关系理解与掌握,注意:电解质不一定导电,导电的不一定是电解质,电解质溶液导电性与离子浓度及离子所带电荷有关,与电解质溶解性、电解质强弱无关,题目难度不大.

练习册系列答案
相关题目
7. 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程所需用到的仪器是:天平(含砝码)、烧杯、药匙、玻璃棒、胶头滴管和250 mL容量瓶
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液的仪器是25mL酸式滴定管(或25mL移液管).
②滴定时,KMnO4溶液应装在酸式 (填“酸式”、“碱式”)滴定管中.
③滴定时所发生反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
④滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
①a的读数如图所示,则a=22.80;
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是BD.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程所需用到的仪器是:天平(含砝码)、烧杯、药匙、玻璃棒、胶头滴管和250 mL容量瓶
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液的仪器是25mL酸式滴定管(或25mL移液管).
②滴定时,KMnO4溶液应装在酸式 (填“酸式”、“碱式”)滴定管中.
③滴定时所发生反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
④滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/m L | 滴定后读数/m L | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是BD.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
5.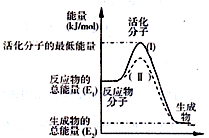 已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q
已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q
(1)写出反应的平衡常数表达式:K=$\frac{{c}^{2}(S{{O}_{4}}^{2-})c({{I}_{3}}^{-})}{{c}^{3}({I}^{-})c({S}_{2}{{O}_{8}}^{2-})}$.
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q>0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是(II)曲线.
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大.如表是在20℃进行实验时所记录的数据
从表中数据分析,该实验的目的是研究I-、S2O82-浓度对反应速率的影响;表中显色时间t1=22s;最终得出的结论是反应速率与反应物浓度乘积成正比.
 已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q
已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q(1)写出反应的平衡常数表达式:K=$\frac{{c}^{2}(S{{O}_{4}}^{2-})c({{I}_{3}}^{-})}{{c}^{3}({I}^{-})c({S}_{2}{{O}_{8}}^{2-})}$.
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q>0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是(II)曲线.
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大.如表是在20℃进行实验时所记录的数据
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
2.下列说法不正确的是( )
| A. | 1 mol氧气中含有1.204×1024个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol臭氧和1.5 mol氧气含有相同的氧原子数 | |
| C. | 当He、H2、O2三种气体的温度和密度都相同时,它们的压强大小是p(O2)>p(He)>p(H2) | |
| D. | 等物质的量的干冰和葡萄糖(分子式为C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
6.下列说法中正确的是( )
| A. | 分子组成相差一个或几个CH2原子团的有机物是同系物 | |
| B. | 各组成元素质量分数相同的烃是同一种烃 | |
| C. | 分子式相同而结构式不同的有机物一定是同分异构体 | |
| D. | 具有相同通式且相差一个或若干个CH2原子团的有机物一定是同系物 |