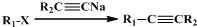题目内容
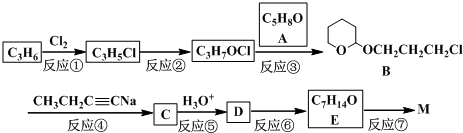
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )

| A、该反应是吸热反应 |
| B、断裂2 mol A-B键需要吸收y kJ的能量 |
| C、2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
| D、断裂1 mol A-A键和1 mol B-B键能放出x kJ的能量 |
考点:化学反应的能量变化规律,吸热反应和放热反应
专题:
分析:A、根据反应物的能量高于生成物的能量时,反应是放热反应;
B、根据旧键的断裂吸收能量,结合图象来判断;
C、根据图象可判断反应物与生成物的总能量.;
D、根据旧键的断裂吸收能量,新键的生成释放能量来回答.
B、根据旧键的断裂吸收能量,结合图象来判断;
C、根据图象可判断反应物与生成物的总能量.;
D、根据旧键的断裂吸收能量,新键的生成释放能量来回答.
解答:
解:A、因反应物的能量高于生成物的能量时,反应是放热反应,故A错误;
B、因旧键的断裂吸收能量,由图可知断裂2molA-B键需要吸收ykJ能量,故B正确;
C、由图可知,1molA2和1molB2的总能量高于2molAB的总能量,故C错误;
D、旧键的断裂吸收能量,而不是释放能量,故D错误;
故选B.
B、因旧键的断裂吸收能量,由图可知断裂2molA-B键需要吸收ykJ能量,故B正确;
C、由图可知,1molA2和1molB2的总能量高于2molAB的总能量,故C错误;
D、旧键的断裂吸收能量,而不是释放能量,故D错误;
故选B.
点评:本题考查学生有关化学反应中的能量变化知识,可以根据所学知识来进行,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列条件下,两物质所含分子数不相等的是( )
| A、同温度、相同质量的N2和CO |
| B、常温常压,同体积的H2O和O2 |
| C、同压强、同物质的量的N2和O2 |
| D、同体积、同密度的N2和CO |
下列离子方程式中,正确的是( )
| A、向AlCl3溶液中滴加过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、CaCO3与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、小苏打治疗胃酸过多:CO32-+2H+=CO2↑+2H2O |
| D、Cu片与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、在常温下,22.4L氧气所含的分子总数为NA |
| B、在标准状况下,NA个CO2分子与NA个H2SO4分子所占的体积之比为1:1 |
| C、标准准况下,22.4L 乙醇中含有NA个乙醇分子 |
| D、在1L 0.1mol/L的碳酸钠溶液中,所含Na+的数目为0.2NA |
稀HNO3还原产物可以是:①NO、②N2O、③N2、④NH4NO3.在稀HNO3和Zn的反应中,若有1mol HNO3参加反应,则有0.8mol电子转移,由此推断稀HNO3的还原产物为( )
| A、仅④ | B、②和④ |
| C、③和④ | D、仅② |
在指定条件下,下列各组离子可能大量共存的是( )
| A、无色澄清透明溶液中:H+、Cu2+、SO42-、Cl- |
| B、与铝反应放出H2的溶液中:NH4+、K+、NO3-、Br- |
| C、由水电离的c(OH-)=10-13mol?L-1的溶液中:Na+、Cl-、CO32-、NO3- |
| D、滴加酚酞显红色的溶液中:Na+、ClO-、S2-、SO42- |
将质量为W1克的钠、铝共融物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为a mol/L的HCl溶液,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干灼烧得固体W2克.n(Na)、n(Al)分别代表钠、铝的物质的量,下列关系式中不正确的是( )
| A、35.5aV2=W2-W1 |
| B、n(Al)<W1/50 |
| C、n(Na)+3n(Al)=2V1/22.4 |
| D、aV2=n(Na)+3n(Al) |
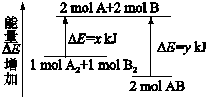
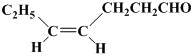 )不溶于水,是一种昂贵的食用香料,也是重要的医药中间体.M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体.
)不溶于水,是一种昂贵的食用香料,也是重要的医药中间体.M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体.