题目内容
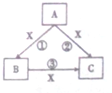 在化学反应中,反应物相同时,因反应条件不同或反应物的量不同产物可能不同,已知A,B,C,X均为中学化学中的常见物质,在常温下它们有如图转化关系(部分产物已略去)回答下列问题
在化学反应中,反应物相同时,因反应条件不同或反应物的量不同产物可能不同,已知A,B,C,X均为中学化学中的常见物质,在常温下它们有如图转化关系(部分产物已略去)回答下列问题若X为一种金属单质,A,B,C均为化合物,则X为
考点:无机物的推断
专题:推断题
分析:若X为一种金属单质,A,B,C均为化合物,由转化关系可知,X为变价金属,则X为Fe,因反应条件不同或反应物的量不同产物可能不同,则A为HNO3,B为Fe(NO3)3,C为Fe(NO3)2,符合转化关系.
解答:
解:若X为一种金属单质,A,B,C均为化合物,由转化关系可知,X为变价金属,则X为Fe,因反应条件不同或反应物的量不同产物可能不同,则A为HNO3,B为Fe(NO3)3,C为Fe(NO3)2,符合转化关系,反应②的离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,
故答案为:Fe;Fe(NO3)2;3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
故答案为:Fe;Fe(NO3)2;3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
点评:本题考查无机物推断,难度中等,需要学生熟练掌握元素化合物知识,注意掌握常见条件不同、量不同导致产物不同的反应.

练习册系列答案
 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.则下列热化学方程式不正确的是( )
| 化学键 | A-A | B-B | A-B |
| 生成1mol化学键时放出的能量 | 436kJ?mol-1 | 243kJ?mol-1 | 431kJ?mol-1 |
A、
| ||||
| B、A2(g)+B2(g)═2AB(g)△H=-183kJ?mol-1 | ||||
C、
| ||||
| D、2AB(g)═A2(g)+B2(g))△H=+183kJ?mol-1 |
某废水处理厂处理废水中NH4+的过程如下下列叙述正确的是( )
①NH4+(aq)+
O2(g)═HNO2(aq)+H+(aq)+H2O(l)△H=-b kJ?mol-1
②2HNO2(aq)+O2(g)═2NO3-(aq)+2H+△H=-a kJ?mol-1.
①NH4+(aq)+
| 3 |
| 2 |
②2HNO2(aq)+O2(g)═2NO3-(aq)+2H+△H=-a kJ?mol-1.
A、将NH4+转化为NO3-的热化学方程式可表示为:NH4+(aq)+2O2(g)═NO3-+2H+(aq)+H2O(l)△H=-(b+
| ||
| B、在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 | ||
| C、常温下,若HNO2溶液中c(H+)=0.1 mol?L-1,则该溶液的pH>1 | ||
| D、若上述两次转化完全,不考虑其它杂质离子的存在,则:c(NH4+)+c(OH-)═c(NO3-)+c(H+) |
如图为一些常见有机物的转化关系,下列说法正确的是( )

| A、反应①②是加成反应,其它所标明的反应都是取代反应 |
| B、上述物质中能与NaOH溶液反应的只有乙酸 |
| C、等物质的量的乙烯和乙醇与足量氧气反应时耗氧量相同 |
| D、1,2-二溴乙烷、乙烯、乙醇烃基上的氢被氯取代,其一氯取代产物都是一种 |
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是 ( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 澄清石灰水 |
| ② | HCl | CO2 | Ba(OH)2 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| A、①②③④ | B、①②③④⑤ |
| C、②③④ | D、①③④ |
下列说法正确的是( )
| A、欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸 |
| B、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| C、C3H2Cl6的六氯代物共有4种,而且CH3-CH=CH-CH3与C3H6一定互为同系物 |
| D、.将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是还原糖 |
下列变化使所得溶液的pH=7的是 ( )
| A、将25℃pH=7的NaCl溶液加热至80℃ |
| B、常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合 |
| C、常温下,pH=2的NaHSO4溶液与pH=12的NaOH溶液等体积混合 |
| D、常温下,0.1 mol?L-1的Na2CO3溶液和0.1 mol?L-1的HCl溶液按体积比1:2混合 |
水的电离过程为H2O?H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14.则下列叙述正确的是( )
| A、c(H+)随温度的升高而降低 |
| B、35℃时,c(H+)>c(OH-) |
| C、溶液:pH(35℃)>pH(25℃) |
| D、水的电离是吸热的过程 |
