题目内容
下列变化使所得溶液的pH=7的是 ( )
| A、将25℃pH=7的NaCl溶液加热至80℃ |
| B、常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合 |
| C、常温下,pH=2的NaHSO4溶液与pH=12的NaOH溶液等体积混合 |
| D、常温下,0.1 mol?L-1的Na2CO3溶液和0.1 mol?L-1的HCl溶液按体积比1:2混合 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.升高温度促进水电离,溶液中c(H+)增大;
B.常温下,pH=2的CH3COOH溶液浓度大于pH=12的NaOH溶液,二者等体积混合,醋酸有剩余;
C.常温下,pH=2的NaHSO4溶液与pH=12的NaOH溶液等体积混合,二者恰好反应生成硫酸钠和水;
D.常温下,0.1 mol?L-1的Na2CO3溶液和0.1 mol?L-1的HCl溶液按体积比1:2混合,二者恰好反应生成碳酸氢钠.
B.常温下,pH=2的CH3COOH溶液浓度大于pH=12的NaOH溶液,二者等体积混合,醋酸有剩余;
C.常温下,pH=2的NaHSO4溶液与pH=12的NaOH溶液等体积混合,二者恰好反应生成硫酸钠和水;
D.常温下,0.1 mol?L-1的Na2CO3溶液和0.1 mol?L-1的HCl溶液按体积比1:2混合,二者恰好反应生成碳酸氢钠.
解答:
解:A.升高温度促进水电离,溶液中c(H+)增大,则溶液的pH小于7,故A错误;
B.常温下,pH=2的CH3COOH溶液浓度大于pH=12的NaOH溶液,二者等体积混合,醋酸有剩余,溶液呈酸性,溶液的pH<7,故B错误;
C.常温下,pH=2的NaHSO4溶液与pH=12的NaOH溶液等体积混合,二者恰好反应生成硫酸钠和水,硫酸钠是强酸强碱盐,其溶液呈中性,pH=7,故C正确;
D.常温下,0.1 mol?L-1的Na2CO3溶液和0.1 mol?L-1的HCl溶液按体积比1:2混合,二者恰好反应生成碳酸氢钠,碳酸氢钠中碳酸氢根离子水解程度大于电离程度,溶液呈碱性,pH>7,故D错误;
故选C.
B.常温下,pH=2的CH3COOH溶液浓度大于pH=12的NaOH溶液,二者等体积混合,醋酸有剩余,溶液呈酸性,溶液的pH<7,故B错误;
C.常温下,pH=2的NaHSO4溶液与pH=12的NaOH溶液等体积混合,二者恰好反应生成硫酸钠和水,硫酸钠是强酸强碱盐,其溶液呈中性,pH=7,故C正确;
D.常温下,0.1 mol?L-1的Na2CO3溶液和0.1 mol?L-1的HCl溶液按体积比1:2混合,二者恰好反应生成碳酸氢钠,碳酸氢钠中碳酸氢根离子水解程度大于电离程度,溶液呈碱性,pH>7,故D错误;
故选C.
点评:本题考查酸碱混合溶液定性判断,明确溶液中的溶质及其性质是解本题关键,易错选项是A,升高温度促进水电离,溶液的pH小于7,但溶液仍然呈中性,为易错点.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
对于反应A2+3B2?2C来说,以下化学反应速率的表示中,反应速率最快的是( )
| A、v(B2)=0.08 mol?(L?s)-1 |
| B、v(A2)=0.04 mol?(L?s)-1 |
| C、v(C)=3.6 mol?(L?min)-1 |
| D、v(B2)=5.4 mol?(L?min)-1 |
在下列物质 ①NaHCO3 ②MgCl2 ③Na2CO3 ④(NH4)2CO3中,与盐酸和氢氧化钙溶液均可反应的是( )
| A、③④ | B、①③④ | C、② | D、① |
下列气体:①Cl2 ②SO2 ③NO2 ④NH3 ⑤H2S ⑥H2不能用浓硫酸干燥的是( )
| A、只有④ | B、④⑤ |
| C、②④⑤⑥ | D、全部 |
某学生用优质大理石与稀盐酸反应制取CO2,实验结果如图所示,对于图中曲线的叙述正确的是( )


| A、OC段表示反应物中气体体积随时间的变化关系 |
| B、BC段反应速率最快,在该时间内收集到的气体最多 |
| C、AB段表示反应速率最慢 |
| D、OC段表示随时间增加,反应速率逐渐增大 |
下列关于葡萄糖的说法错误的是( )
| A、葡萄糖的分子式是C6H12O6 |
| B、葡萄糖属于单糖 |
| C、葡萄糖是碳水化合物,因为它的分子是由6个碳原子和6个水分子组成 |
| D、葡萄糖能与新制的氢氧化铜悬浊液共热反应,生成砖红色的沉淀 |
在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A、K+、Na+、NO3-、MnO4- |
| B、Mg2+、Na+、Cl-、SO42- |
| C、K+、Cu2+、Br-、S2- |
| D、NH4+、Al3+、I-、NO3- |
国家“十二五规划”中明确提出了节能减排的目标,以下做法不符合节能减排的是( )
| A、在钢铁等高耗能行业发展余热余压利用工程 |
| B、以煤炭气化替代燃料油和原料油的使用 |
| C、用第四代LED绿色光源替代白炽灯 |
| D、使用冰箱时,尽可能在冰箱内装满食物 |
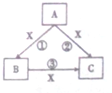 在化学反应中,反应物相同时,因反应条件不同或反应物的量不同产物可能不同,已知A,B,C,X均为中学化学中的常见物质,在常温下它们有如图转化关系(部分产物已略去)回答下列问题
在化学反应中,反应物相同时,因反应条件不同或反应物的量不同产物可能不同,已知A,B,C,X均为中学化学中的常见物质,在常温下它们有如图转化关系(部分产物已略去)回答下列问题