题目内容
水的电离过程为H2O?H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14.则下列叙述正确的是( )
| A、c(H+)随温度的升高而降低 |
| B、35℃时,c(H+)>c(OH-) |
| C、溶液:pH(35℃)>pH(25℃) |
| D、水的电离是吸热的过程 |
考点:离子积常数,水的电离
专题:电离平衡与溶液的pH专题
分析:水的电离过程为H2O?H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14,说明升高温度促进水电离,升高温度后水中c(H+)增大,其pH减小,但仍然存在c(H+)=c(OH-),据此分析解答.
解答:
解:水的电离过程为H2O?H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14,说明升高温度促进水电离,升高温度后水中c(H+)增大,其pH减小,但仍然存在c(H+)=c(OH-),
A.升高温度促进水电离,则c(H+)随温度的升高而增大,故A错误;
B.升高温度促进水电离,但水中仍然存在c(H+)=c(OH-),呈中性,故B错误;
C.升高温度促进水电离,则c(H+)随温度的升高而增大,所以温度越高,水的pH越小,故C错误;
D.升高温度,水的离子积常数增大,说明升高温度促进水电离,则水的电离是吸热反应,故D正确;
故选D.
A.升高温度促进水电离,则c(H+)随温度的升高而增大,故A错误;
B.升高温度促进水电离,但水中仍然存在c(H+)=c(OH-),呈中性,故B错误;
C.升高温度促进水电离,则c(H+)随温度的升高而增大,所以温度越高,水的pH越小,故C错误;
D.升高温度,水的离子积常数增大,说明升高温度促进水电离,则水的电离是吸热反应,故D正确;
故选D.
点评:本题考查水的电离,侧重考查学生获取信息、分析学习能力,知道离子积常数与温度的关系是解本题关键,注意:无论水的电离程度多大,水不能变为酸或碱,仍然呈中性,为易错点.

练习册系列答案
相关题目
下列关于葡萄糖的说法错误的是( )
| A、葡萄糖的分子式是C6H12O6 |
| B、葡萄糖属于单糖 |
| C、葡萄糖是碳水化合物,因为它的分子是由6个碳原子和6个水分子组成 |
| D、葡萄糖能与新制的氢氧化铜悬浊液共热反应,生成砖红色的沉淀 |
在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A、K+、Na+、NO3-、MnO4- |
| B、Mg2+、Na+、Cl-、SO42- |
| C、K+、Cu2+、Br-、S2- |
| D、NH4+、Al3+、I-、NO3- |
 某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.该厂污水处理设计装置如图所示,下列说法正确的是( )
某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.该厂污水处理设计装置如图所示,下列说法正确的是( )| A、通入空气的电极为阳极 |
| B、甲装置中Fe电极的反应为Fe-3e-═Fe3+ |
| C、为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环物质为CO2 |
| D、当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为8.96 L |
 某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.下列叙述错误的是 ( )
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.下列叙述错误的是 ( )| A、该反应的化学方程式是2X?3Y+Z |
| B、在t1min时,该反应达到了平衡状态 |
| C、t1min时,X、Y、Z的反应速率相等 |
| D、当该反应已达到平衡状态时,每生成1molZ的同时生成2molX |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
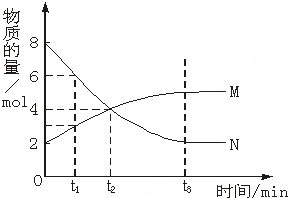

| A、反应的化学方程式为:M?N |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t1时,N的浓度是M浓度的2倍 |
国家“十二五规划”中明确提出了节能减排的目标,以下做法不符合节能减排的是( )
| A、在钢铁等高耗能行业发展余热余压利用工程 |
| B、以煤炭气化替代燃料油和原料油的使用 |
| C、用第四代LED绿色光源替代白炽灯 |
| D、使用冰箱时,尽可能在冰箱内装满食物 |
有A、B、C、D、E、F六种元素,其中A、B、C、D、E为原子序数依次增大的短周期元素.已知:①原子半径:A<C<B<E<D;②原子的最外层电子数:A=D、C=E、A+B=C;③原子的电子层数:B=C=2A;④B元素的最高正价与最低负价的绝对值之差为2;⑤F为地壳中含量第二的金属元素.下列说法正确的是( )
| A、B的氧化物对应水化物为强酸 |
| B、F单质与C单质反应的产物只有一种 |
| C、因为E单质的相对分子质量小于溴单质的相对分子质量,所以E单质的熔点比溴单质要低 |
| D、A、D形成的化合物的水溶液呈碱性 |
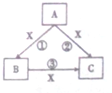 在化学反应中,反应物相同时,因反应条件不同或反应物的量不同产物可能不同,已知A,B,C,X均为中学化学中的常见物质,在常温下它们有如图转化关系(部分产物已略去)回答下列问题
在化学反应中,反应物相同时,因反应条件不同或反应物的量不同产物可能不同,已知A,B,C,X均为中学化学中的常见物质,在常温下它们有如图转化关系(部分产物已略去)回答下列问题