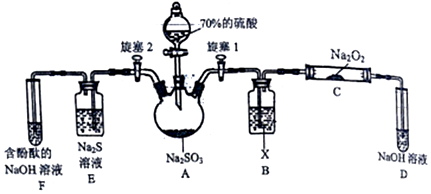
题目内容
7.高效低毒的杀虫剂氰菊酯(I)可通过下列反应制备:
(1)F的分子式为C10H14O2Cl2,I中官能团的名称为氯原子、碳碳双键、酯基、醚键.
(2)F→G一步反应的反应类型为取代反应.
(3)反应①为加成反应,写出A、B的结构简式(CH3)2C=CH2;Cl3C-CHO.
(4)D分子中最多有10个原子共平面.
(5)已知化合物H的结
 ,G→I一步反应的产物除了I、N(C2H5)3、还有NaCl
,G→I一步反应的产物除了I、N(C2H5)3、还有NaCl(6)芳香化合物J比F的分子只少一个氧多两个氢原子,且满足下列条件
①不与FeCl3溶液显色
②核磁共振氢谱显示J分子中有三种氢,个数比为9:2:1
写出一种满足上述条件的J的结构简式
 .
.(7)已知:一个碳原子上连有两个或三个羟基时,容易发生分子内脱水,两个羟基脱一分子水形成一个碳氧双键
C$\stackrel{NaOH,H_{2}O}{→}$K$\stackrel{H+}{→}$L$\stackrel{一定条件}{→}$M(高分子)
①C→K的反应方程式CH2=C(CH3)CH2CHOHCCl3+4NaOH$\stackrel{△}{→}$CH2=C(CH3)CH2CHOHCOONa+3NaCl+2H2O
②写出M的两种可能的结构
 或
或 .
.
分析 化合物A能使溴的四氯化碳溶液褪色,结合C的结构简式以及A、B分子式可知,A为(CH3)2C=CH2,B为Cl3C-CHO;F为 ,和氢氧化钠水溶液反应,故G为
,和氢氧化钠水溶液反应,故G为 ,以此解答(1)~(5);
,以此解答(1)~(5);
(6)J比F的分子只少一个氧多两个氢原子,则J的分子式为C10H16OCl2,分子中含有4个不饱和度,则分子中除含有一个苯环外,其余碳原子均为饱和碳原子.根据题意,J分子中含有3种氢原子,且个数比为9:2:1,其中有9个氢原子为一种,则可能含有3个相同的甲基或-C(CH3)3,不与FeCl3溶液显色,故分子中没有酚羟基;
(7)C为CH2=C(CH3)CH2CHOHCCl3,在碱性条件下水解,碳原子上连有两个或三个羟基时,容易发生分子内脱水,两个羟基脱一分子水形成一个碳氧双键,可K为CH2=C(CH3)CH2CHOHCOONa,L为CH2=C(CH3)CH2CHOHCOOH,L可发生缩聚或加聚反应.
解答 解:(1)F的分子式为C10H14O2Cl2,根据I的结构简式,可知其含有的官能团有:氯原子、碳碳双键、酯基、醚键,
故答案为:C10H14O2Cl2;氯原子、碳碳双键、酯基、醚键;
(2)F→G反应为 +NaOH$\stackrel{{H}_{2}O}{→}$
+NaOH$\stackrel{{H}_{2}O}{→}$ +C2H5OH,故为取代反应,
+C2H5OH,故为取代反应,
故答案为:取代反应;
(3)由以上分析得A为(CH3)2C=CH2,B为Cl3C-CHO,
故答案为:(CH3)2C=CH2;Cl3C-CHO;
(4)D的结构简式为 ,与碳碳双键直接相连的原子在同一个平面上,D分子中最多有10个原子共平面,
,与碳碳双键直接相连的原子在同一个平面上,D分子中最多有10个原子共平面,
故答案为:10;
(5)对比G、I的结构可知,G中Na被取代生成I,同时生成N(CH2CH3)3,根据化学反应前后元素守恒,故另一生成物NaCl,
故答案为:NaCl;
(6)J比F的分子只少一个氧多两个氢原子,则J的分子式为C10H16OCl2,分子中含有4个不饱和度,则分子中除含有一个苯环外,其余碳原子均为饱和碳原子.根据题意,J分子中含有3种氢原子,且个数比为9:2:1,其中有9个氢原子为一种,则可能含有3个相同的甲基或-C(CH3)3,不与FeCl3溶液显色,故分子中没有酚羟基,故J可能的结构为 ,
,
故答案为: ;
;
(7)C为CH2=C(CH3)CH2CHOHCCl3,在碱性条件下水解,碳原子上连有两个或三个羟基时,容易发生分子内脱水,两个羟基脱一分子水形成一个碳氧双键,可K为CH2=C(CH3)CH2CHOHCOONa,L为CH2=C(CH3)CH2CHOHCOOH,
①C为CH2=C(CH3)CH2CHOHCCl3,K为CH2=C(CH3)CH2CHOHCOONa,C→K的反应方程式为CH2=C(CH3)CH2CHOHCCl3+4NaOH$\stackrel{△}{→}$CH2=C(CH3)CH2CHOHCOONa+3NaCl+2H2O,
故答案为:CH2=C(CH3)CH2CHOHCCl3+4NaOH$\stackrel{△}{→}$CH2=C(CH3)CH2CHOHCOONa+3NaCl+2H2O;
②L为CH2=C(CH3)CH2CHOHCOOH,可发生缩聚或加聚反应,产物可为 或
或 ,
,
故答案为: 或
或 .
.
点评 本题考查有机物推断与合成,为高频考点,题目涉及官能团结构与性质、同分异构体书写、有机反应方程式书写等,是对有机化学的综合可知,侧重考查学生分析推理、知识迁移应用,难点中等.

| A. | H${\;}_{2}^{16}$O、D${\;}_{2}^{16}$O、H${\;}_{2}^{18}$O、D${\;}_{2}^{18}$O互为同位素 | |
| B. | 金刚石、石墨均为碳的同素异形体,其化学性质与物理性质均相似 | |
| C. | 石墨烯(结构如图 所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 | |
| D. | 由于氢原子可以形成H-(如NaH),所以有人建议可将氢元素排在元素周期表的ⅦA族 |
【查阅资料】FeCl3•6H2O是棕黄色晶体,熔点37℃,沸点280~285℃.
【实验设计】
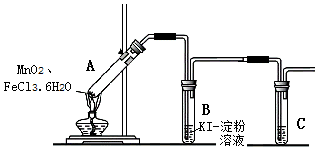
若结论成立,B中发生反应的化学方程式是Cl2+2KI=2KCl+I2,C中的试剂是NaOH溶液.
【实验过程】
| 操作 | 现象 |
| (1)经检查,装置气密性良好. (2)添加药品,连接装置. (3)点燃酒精灯. | i.A中部分固体熔化,上方出现白雾; ii.稍后,产生黄色气体,管壁附着黄色液滴; iii.B中溶液变蓝. |
(1)小组讨论一致认为现象i中的白雾是盐酸小液滴,产生白雾的原因是FeCl3•6H2O受热水解增强,生成HCl气体同时失去结晶水,HCl与H2O结合形成盐酸小液滴.
(2)分析现象ii时发生了分歧,有同学认为:FeCl3•6H2O是棕黄色,沸点不高,黄色气体重含有FeCl3也会导致B中溶液变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.
小组同学通过下列实验证明现象ii的黄色气体中含有Fe3+,将下列实验补充完整:
a.只在A中加入FeCl3•6H2O,加热,开始产生白雾,稍后出现黄色气体,管壁仍有黄色液滴.
b.将黄色气体通入B中的KSCN溶液,溶液变红.
(3)为进一步确认黄色气体含有 Cl2,小组在A、B 间增加盛有饱和氯化钠溶液的试管,气体依次通过饱和氯化钠溶液、KI淀粉溶液后,KI淀粉溶液变蓝,证实黄色气体中含有Cl2.饱和氯化钠溶液的主要作用是除去气体中的FeCl3.
(4)A中固体充分加热后得到Fe2O3和MnCl2,若物质的量之比为1:1,则A中总反应的化学方程式是MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O.从混合物中分离出Fe2O3的方法是:加足量水溶解,过滤,洗涤固体,干燥,即得Fe2O3.
【安全预案】在实验过程中,若试管B中溶液已经开始发生倒吸,应立即采取的一种措施是c(填写编号).
a.移去酒精灯
b.取下B中盛有溶液的试管
c.将A、B间的导管从乳胶管中取出.
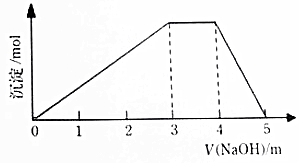 中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )
中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 由R、X、Y、M四种元素只组成一种盐 | |
| D. | 最高价氧化物对应水化物的酸性:M>Z |
| A. | 碳酸钙受热分解 | B. | 食物氧化腐败 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 酸与碱的中和反应 |
| A. | 当0<b<$\frac{a}{3}$时:SO2+H2O+3ClO-=SO42-+2HClO+Cl- | |
| B. | 当b=a时,SO2+H2O+ClO-═2H++Cl-+SO42- | |
| C. | 当$\frac{a}{3}$≤b≤a时,反应后溶液中H+的物质的量:0<n(H+)≤2bmol | |
| D. | 当0<b<a时,反应后溶液中ClO-、Cl-和SO42-物质的量之比为:(a-b):b:b |
| 化学式 | 电离常数 |
| HClO | K=3×10-9 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A. | 原溶液中:c(ClO-)>c(OH-)>c(H+) | |
| B. | 原溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 反应后溶液中 c(HClO)>c(HCO3-)>c(ClO)>c(CO32-) | |
| D. | 反应后溶液中 c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)+c(ClO-)+c(HClO) |