题目内容
3.某化合物X 3.2g在氧气中完全燃烧,只生成4.4gCO2和3.6 H2O,下列说法正确的是( )| A. | 化合物X是烃类物质 | B. | 化合物X的实验式为CH4 | ||
| C. | 化合物X具有多种同分异构体 | D. | 可以确定化合物X的结构式 |
分析 完全燃烧,只生成4.4g CO2和3.6g H2O,则有机物一定含C、H元素,m(C)=$\frac{4.4g}{44g/mol}$×12g/mol=1.2g,m(H)=$\frac{3.6g}{18g/mol}$×2×1g/mol=0.4g,1.2g+0.4g=1.6g<3.2g,则有机物一定含O元素,该化合物中C、H、O原子个数比=$\frac{4.4g}{44g/mol}$:($\frac{3.6g}{18g/mol}$×2):$\frac{3.2g-1.6g}{16g/mol}$=1:4:1,其实验式为CH4O,结合H原子已经达到饱和分析.
解答 解:完全燃烧,只生成4.4g CO2和3.6g H2O,则有机物一定含C、H元素,m(C)=$\frac{4.4g}{44g/mol}$×12g/mol=1.2g,m(H)=$\frac{3.6g}{18g/mol}$×2×1g/mol=0.4g,1.2g+0.4g=1.6g<3.2g,则该有机物一定含O元素,
A.有机物含C、H、O元素,不属于烃类,故A错误;
B.该化合物中C、H、O原子个数比=$\frac{4.4g}{44g/mol}$:($\frac{3.6g}{18g/mol}$×2):$\frac{3.2g-1.6g}{16g/mol}$=1:4:1,其实验式为CH4O,故B错误;
C.X的实验式为CH4O,由于H达到饱和,其分子式为CH4O,为甲醇,不存在同分异构体,故C错误;
D.根据C可知X为甲醇,能够确定其结构式,故D正确;
故选D.
点评 本题考查有机物分子式计算的确定,为高频考点,把握有机物的燃烧规律及原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.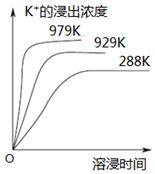 已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
 已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )| A. | 该平衡的Ksp=c2(Ca2+)•c2(K+)•c(Mg2+)•c4(SO42-) | |
| B. | 向该体系中加入饱和K2SO4溶液,溶解平衡向左移动 | |
| C. | 升高温度,溶浸速率增大,平衡向正反应方向移动 | |
| D. | 向该体系中加入饱和NaOH溶液,溶解平衡不发生移动 |
18.某学习小组分析实验室制氯气的方法后认为:MnO2与FeCl3•6H2O共热能产生Cl2,于是设计了如图装置验证该结论.
【查阅资料】FeCl3•6H2O是棕黄色晶体,熔点37℃,沸点280~285℃.
【实验设计】
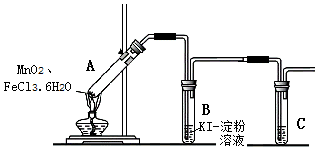
若结论成立,B中发生反应的化学方程式是Cl2+2KI=2KCl+I2,C中的试剂是NaOH溶液.
【实验过程】
【实验分析】
(1)小组讨论一致认为现象i中的白雾是盐酸小液滴,产生白雾的原因是FeCl3•6H2O受热水解增强,生成HCl气体同时失去结晶水,HCl与H2O结合形成盐酸小液滴.
(2)分析现象ii时发生了分歧,有同学认为:FeCl3•6H2O是棕黄色,沸点不高,黄色气体重含有FeCl3也会导致B中溶液变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.
小组同学通过下列实验证明现象ii的黄色气体中含有Fe3+,将下列实验补充完整:
a.只在A中加入FeCl3•6H2O,加热,开始产生白雾,稍后出现黄色气体,管壁仍有黄色液滴.
b.将黄色气体通入B中的KSCN溶液,溶液变红.
(3)为进一步确认黄色气体含有 Cl2,小组在A、B 间增加盛有饱和氯化钠溶液的试管,气体依次通过饱和氯化钠溶液、KI淀粉溶液后,KI淀粉溶液变蓝,证实黄色气体中含有Cl2.饱和氯化钠溶液的主要作用是除去气体中的FeCl3.
(4)A中固体充分加热后得到Fe2O3和MnCl2,若物质的量之比为1:1,则A中总反应的化学方程式是MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O.从混合物中分离出Fe2O3的方法是:加足量水溶解,过滤,洗涤固体,干燥,即得Fe2O3.
【安全预案】在实验过程中,若试管B中溶液已经开始发生倒吸,应立即采取的一种措施是c(填写编号).
a.移去酒精灯
b.取下B中盛有溶液的试管
c.将A、B间的导管从乳胶管中取出.
【查阅资料】FeCl3•6H2O是棕黄色晶体,熔点37℃,沸点280~285℃.
【实验设计】

若结论成立,B中发生反应的化学方程式是Cl2+2KI=2KCl+I2,C中的试剂是NaOH溶液.
【实验过程】
| 操作 | 现象 |
| (1)经检查,装置气密性良好. (2)添加药品,连接装置. (3)点燃酒精灯. | i.A中部分固体熔化,上方出现白雾; ii.稍后,产生黄色气体,管壁附着黄色液滴; iii.B中溶液变蓝. |
(1)小组讨论一致认为现象i中的白雾是盐酸小液滴,产生白雾的原因是FeCl3•6H2O受热水解增强,生成HCl气体同时失去结晶水,HCl与H2O结合形成盐酸小液滴.
(2)分析现象ii时发生了分歧,有同学认为:FeCl3•6H2O是棕黄色,沸点不高,黄色气体重含有FeCl3也会导致B中溶液变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.
小组同学通过下列实验证明现象ii的黄色气体中含有Fe3+,将下列实验补充完整:
a.只在A中加入FeCl3•6H2O,加热,开始产生白雾,稍后出现黄色气体,管壁仍有黄色液滴.
b.将黄色气体通入B中的KSCN溶液,溶液变红.
(3)为进一步确认黄色气体含有 Cl2,小组在A、B 间增加盛有饱和氯化钠溶液的试管,气体依次通过饱和氯化钠溶液、KI淀粉溶液后,KI淀粉溶液变蓝,证实黄色气体中含有Cl2.饱和氯化钠溶液的主要作用是除去气体中的FeCl3.
(4)A中固体充分加热后得到Fe2O3和MnCl2,若物质的量之比为1:1,则A中总反应的化学方程式是MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O.从混合物中分离出Fe2O3的方法是:加足量水溶解,过滤,洗涤固体,干燥,即得Fe2O3.
【安全预案】在实验过程中,若试管B中溶液已经开始发生倒吸,应立即采取的一种措施是c(填写编号).
a.移去酒精灯
b.取下B中盛有溶液的试管
c.将A、B间的导管从乳胶管中取出.
8.下列说法正确的是( )
| A. | 甲苯的一氯代物有三种同分异构体 | |
| B. | 乙醇能使高锰酸钾溶液褪色 | |
| C. | 乙烯、苯、乙酸分子中的所有原子都在同一个平面上 | |
| D. | C2H4O2和C4H8O2分子组成相差2个CH2,一定互为同系物 |
15.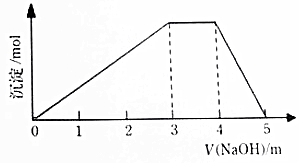 中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )
中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )
 中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )
中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 由R、X、Y、M四种元素只组成一种盐 | |
| D. | 最高价氧化物对应水化物的酸性:M>Z |
12.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 碳酸钙受热分解 | B. | 食物氧化腐败 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 酸与碱的中和反应 |
8.中和热测定实验中,量取反应物时,取50mL 0.50mol•L-1的盐酸,还需加入的试剂是 ( )(填序号).
| A. | 50mL 0.50mol•L-1NaOH溶液 | B. | 50mL 0.55mol•L-1NaOH溶液 | ||
| C. | 1.0gNaOH固体 |