题目内容
20.500mL KNO3和 Cu(NO3)2的混合溶液中 c(NO3-)=6mol•L-1,用石墨做电极电解此混合溶液,通电一段时间后,两极均收集到 22.4L(标准状况)气体,假定电解后溶液体积仍为 500mL,下列说法正确的是( )| A. | 原混合溶液中 c(K+)为 2 mol•L-1 | |
| B. | 电解过程中共转移 8 mol电子 | |
| C. | 电解得到的Cu 的物质的量为 0.5 mol | |
| D. | 电解后溶液中的 c(H+)为 2 mol•L-1 |
分析 石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),
则阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
阳极发生4OH--4e-═O2↑+2H2O,
n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,结合电子守恒及物质的量浓度的计算来解答.
解答 解:石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,
阳极发生4OH--4e-═O2↑+2H2O,
4mol 1mol
阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
1mol 2mol 1mol 2mol 1mol
A.c(Cu2+)=$\frac{1mol}{0.5L}$=2mol/L,由电荷守恒可知,原混合溶液中c(K+)为6mol/L-2mol/L×2=2mol/L,故A正确;
B.由上述分析可知,电解过程中转移电子为4mol,故B错误;
C.电解得到的Cu的物质的量为1mol,故C错误;
D.电解后溶液中c(H+)为$\frac{4mol-2mol}{0.5L}$=4mol/L,故D错误;
故选A.
点评 本题考查电解原理,明确发生的电极反应及电子守恒是解答本题的关键,题目难度中等,选项D为学生解答的难点,注意氢氧根离子与氢离子的关系即可解答.

练习册系列答案
相关题目
15.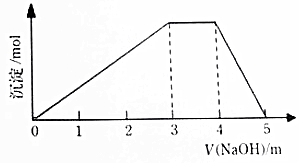 中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )
中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )
 中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )
中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 由R、X、Y、M四种元素只组成一种盐 | |
| D. | 最高价氧化物对应水化物的酸性:M>Z |
16.向0.5L0.4mol/L的NaClO溶液中缓慢通入0.1molCO2根据表提供的数据,下列判断不正确的是( )
| 化学式 | 电离常数 |
| HClO | K=3×10-9 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A. | 原溶液中:c(ClO-)>c(OH-)>c(H+) | |
| B. | 原溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 反应后溶液中 c(HClO)>c(HCO3-)>c(ClO)>c(CO32-) | |
| D. | 反应后溶液中 c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)+c(ClO-)+c(HClO) |
8.中和热测定实验中,量取反应物时,取50mL 0.50mol•L-1的盐酸,还需加入的试剂是 ( )(填序号).
| A. | 50mL 0.50mol•L-1NaOH溶液 | B. | 50mL 0.55mol•L-1NaOH溶液 | ||
| C. | 1.0gNaOH固体 |
15.下列各电离方程式中,书写正确的是 ( )
| A. | Fe(OH)3═Fe3++3OH- | B. | KHSO4?K++H++SO42- | ||
| C. | NH4HCO3═NH4++HCO3- | D. | NaH2PO4═Na++2H++PO43- |
9.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | NCl3 | B. | BF3 | C. | SF6 | D. | HCl |
10.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下.下列说法不正确的是( ) 

| A. | 溶液中OH-向电极a移动 | |
| B. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| C. | 负极的电极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 电子迁移方向:电极a→导线→电极b→电解质溶液→电极a |

 B.
B. C.泡利原理 D.洪特规则
C.泡利原理 D.洪特规则