题目内容
某学生为测定某烧碱样品中NaOH的质量分数,进行如下实验(已知该样品中含有少量Na2CO3杂质)
a.在250mL的容量瓶中定容,配制成250mL烧碱溶液.
b.用碱式滴定管量取25.00mL烧碱溶液于锥形瓶中,加入足量BaCl2溶液使Na2CO3完全转变成BaCO3后滴入几滴酚酞指示剂;
c.在天平上准确称取烧碱样品10.5g,在烧杯中用蒸馏水溶解;
d.将物质的量浓度为1.000mol/L的标准硫酸溶液装入酸式滴定管中,调节液面,记下开始时的读数然后开始滴定.
e.在锥形瓶下垫一张白纸,滴定至溶液恰好变为无色为止,记下读数.试填空:
(1)正确操作步骤的顺序是(用字母填空) → → → → .
(2)酸式(碱式)滴定管在使用前需进行的第一步操作是 ,中学化学实验常用仪器中使用前和滴定管使用有相同操作的不同类玻璃仪器还有 、 .
(3)重复上述滴定操作,记录数据如下:
①根据以上数据,可计算出该样品中NaOH的质量分数为 (保留两位有效数字).
②上述实验中,下列操作(其它操作正确)会造成结果偏低的有 .
A.a步操作中未将溶液冷却至室温就转移到容量瓶中定容.
B.c步操作中,称量药品时,砝码放在左盘,NaOH放在右盘.
C.滴定终点读数时俯视读数.
D.酸式滴定管使用前,未用标准H2SO4溶液润洗.
E.锥形瓶水洗后未干燥就直接盛待测溶液.
③有同学提出将原实验方案中的酚酞指示剂改为甲基橙指示剂,你认为是否可行? (填“可行”或“不可行”).如果改用甲基橙为指示剂,则测定结果如何? (填“偏高”“偏低”或“正确”)
a.在250mL的容量瓶中定容,配制成250mL烧碱溶液.
b.用碱式滴定管量取25.00mL烧碱溶液于锥形瓶中,加入足量BaCl2溶液使Na2CO3完全转变成BaCO3后滴入几滴酚酞指示剂;
c.在天平上准确称取烧碱样品10.5g,在烧杯中用蒸馏水溶解;
d.将物质的量浓度为1.000mol/L的标准硫酸溶液装入酸式滴定管中,调节液面,记下开始时的读数然后开始滴定.
e.在锥形瓶下垫一张白纸,滴定至溶液恰好变为无色为止,记下读数.试填空:
(1)正确操作步骤的顺序是(用字母填空)
(2)酸式(碱式)滴定管在使用前需进行的第一步操作是
(3)重复上述滴定操作,记录数据如下:
| 实验编号 | 标准溶液(H2SO4)(aq) 浓度(mol/L) | 滴定完成时耗酸 体积V(mL) | 待测溶液(NaOH)(aq) 体积V(mL) |
| 1 | 1.000 | 11.00 | 25.00 |
| 2 | 1.000 | 12.04 | 25.00 |
| 3 | 1.000 | 12.18 | 25.00 |
②上述实验中,下列操作(其它操作正确)会造成结果偏低的有
A.a步操作中未将溶液冷却至室温就转移到容量瓶中定容.
B.c步操作中,称量药品时,砝码放在左盘,NaOH放在右盘.
C.滴定终点读数时俯视读数.
D.酸式滴定管使用前,未用标准H2SO4溶液润洗.
E.锥形瓶水洗后未干燥就直接盛待测溶液.
③有同学提出将原实验方案中的酚酞指示剂改为甲基橙指示剂,你认为是否可行?
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据先配制溶液然后除去杂质,最后进行滴定排序;正确的操作顺序为:称量→溶解→定容→取液→除杂→滴定;
(2)酸式(碱式)滴定管在使用前需进行的第一步操作是检查是否漏水(检漏),中学化学实验常用仪器中使用前和滴定管使用有相同操作的不同类玻璃仪器还有分液漏斗、容量瓶;
(3)①分析表中数据知,实验1所用硫酸的体积偏差较大,应舍弃,滴定所用硫酸的体积应取实验2和3的平均值.根据2c(H2SO4)×V(H2SO4)=c(NaOH)×V(NaOH),代入数据计算得c(NaOH)=0.97 mol/L,计算得到烧碱样品中NaOH的质量分数为:
②A、a步操作中未将溶液冷却至室温就转移到容量瓶中定容,会使所配NaOH溶液的浓度偏大,从而使质量分数偏高;
B、c步操作中,称量药品时,砝码放在左盘,NaOH放在右盘,会使所称药品的质量小于10.5 g,会使样品的质量分数偏低;
C、滴定终点读数时俯视读数,会使V(H2SO4)偏小,从而使样品的质量分数偏小;
D、酸式滴定管使用前,未用标准H2SO4溶液润洗,会使V(H2SO4)偏大,从而使样品的质量分数偏大;
E、锥形瓶水洗后未干燥就直接盛待测溶液,对测定结果无影响;
③甲基橙的变色范围3.1--4.4,达到滴定终点时,硫酸会与锥形瓶中的碳酸钡反应,造成所用硫酸的体积偏大,测定结果偏高,不可行.
(2)酸式(碱式)滴定管在使用前需进行的第一步操作是检查是否漏水(检漏),中学化学实验常用仪器中使用前和滴定管使用有相同操作的不同类玻璃仪器还有分液漏斗、容量瓶;
(3)①分析表中数据知,实验1所用硫酸的体积偏差较大,应舍弃,滴定所用硫酸的体积应取实验2和3的平均值.根据2c(H2SO4)×V(H2SO4)=c(NaOH)×V(NaOH),代入数据计算得c(NaOH)=0.97 mol/L,计算得到烧碱样品中NaOH的质量分数为:
②A、a步操作中未将溶液冷却至室温就转移到容量瓶中定容,会使所配NaOH溶液的浓度偏大,从而使质量分数偏高;
B、c步操作中,称量药品时,砝码放在左盘,NaOH放在右盘,会使所称药品的质量小于10.5 g,会使样品的质量分数偏低;
C、滴定终点读数时俯视读数,会使V(H2SO4)偏小,从而使样品的质量分数偏小;
D、酸式滴定管使用前,未用标准H2SO4溶液润洗,会使V(H2SO4)偏大,从而使样品的质量分数偏大;
E、锥形瓶水洗后未干燥就直接盛待测溶液,对测定结果无影响;
③甲基橙的变色范围3.1--4.4,达到滴定终点时,硫酸会与锥形瓶中的碳酸钡反应,造成所用硫酸的体积偏大,测定结果偏高,不可行.
解答:
解:(1)根据先配制溶液然后除去杂质,最后进行滴定排序;正确的操作顺序为:称量→溶解→定容→取液→除杂→滴定,所以操作步骤的顺序为cabde,
故答案为:c;a;b;d;e;
(2)酸式(碱式)滴定管在使用前需进行的第一步操作是检查是否漏水(检漏),中学化学实验常用仪器中使用前和滴定管使用有相同操作的不同类玻璃仪器还有分液漏斗、容量瓶;
故答案为:检漏,分液漏斗、容量瓶;
(3)①分析表中数据知,实验1所用硫酸的体积偏差较大,应舍弃,滴定所用硫酸的体积应取实验2和3的平均值=
=12.11mL.根据2c(H2SO4)×V(H2SO4)=c(NaOH)×V(NaOH)
代入数据计算得c(NaOH)=
=0.9688mol/L,
烧碱样品中NaOH的质量分数为:w(NaOH)=
×100%=92%;
故答案为:92%;
②A、a步操作中未将溶液冷却至室温就转移到容量瓶中定容,会使所配NaOH溶液的浓度偏大,从而使质量分数偏高;
B、c步操作中,称量药品时,砝码放在左盘,NaOH放在右盘,会使所称药品的质量小于10.5 g,会使样品的质量分数偏低;
C、滴定终点读数时俯视读数,会使V(H2SO4)偏小,从而使样品的质量分数偏小;
D、酸式滴定管使用前,未用标准H2SO4溶液润洗,会使V(H2SO4)偏大,从而使样品的质量分数偏大;
E、锥形瓶水洗后未干燥就直接盛待测溶液,对测定结果无影响;
故答案为:BC;
③甲基橙的变色范围3.1--4.4,达到滴定终点时,硫酸会与锥形瓶中的碳酸钡反应,造成所用硫酸的体积偏大,测定结果偏高,不可行.
故答案为:不可行;偏高.
故答案为:c;a;b;d;e;
(2)酸式(碱式)滴定管在使用前需进行的第一步操作是检查是否漏水(检漏),中学化学实验常用仪器中使用前和滴定管使用有相同操作的不同类玻璃仪器还有分液漏斗、容量瓶;
故答案为:检漏,分液漏斗、容量瓶;
(3)①分析表中数据知,实验1所用硫酸的体积偏差较大,应舍弃,滴定所用硫酸的体积应取实验2和3的平均值=
| 12.04+12.18 |
| 2 |
代入数据计算得c(NaOH)=
| 2×1.000mol/L×0.01211L |
| 0.025l |
烧碱样品中NaOH的质量分数为:w(NaOH)=
| 40g/mol×0.9688mol/L×0.25L |
| 10.5g |
故答案为:92%;
②A、a步操作中未将溶液冷却至室温就转移到容量瓶中定容,会使所配NaOH溶液的浓度偏大,从而使质量分数偏高;
B、c步操作中,称量药品时,砝码放在左盘,NaOH放在右盘,会使所称药品的质量小于10.5 g,会使样品的质量分数偏低;
C、滴定终点读数时俯视读数,会使V(H2SO4)偏小,从而使样品的质量分数偏小;
D、酸式滴定管使用前,未用标准H2SO4溶液润洗,会使V(H2SO4)偏大,从而使样品的质量分数偏大;
E、锥形瓶水洗后未干燥就直接盛待测溶液,对测定结果无影响;
故答案为:BC;
③甲基橙的变色范围3.1--4.4,达到滴定终点时,硫酸会与锥形瓶中的碳酸钡反应,造成所用硫酸的体积偏大,测定结果偏高,不可行.
故答案为:不可行;偏高.
点评:本题考查了物质组成和实验探究方法,实验过程分析判断,中和滴定实验标准和过程计算的分析应用,掌握基本操作和物质组成是解题关键,题目难度中等.

练习册系列答案
相关题目
下列排列顺序正确的是( )
| A、常温下水电离出的c(H+):pH=5的CH3COOH溶液>pH=5的盐酸 |
| B、微粒半径:Fe(OH)3胶粒>K+>C1->Na+ |
| C、等温等物质的量浓度溶液的pH:Na2CO3>苯酚钠>NaHCO3 |
| D、氢化物的沸点:H2Se>H2S>H2O |
下列物质的化学用语正确的是( )
①NH4H的电子式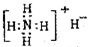
②硝基苯的结构简式:
③葡萄糖的实验式:CH2O
④甲烷分子的比例模型: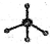
⑤Fe2+的离子结构:
⑥原子核内有10个中子的氧原子:
O.
①NH4H的电子式
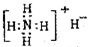
②硝基苯的结构简式:

③葡萄糖的实验式:CH2O
④甲烷分子的比例模型:

⑤Fe2+的离子结构:

⑥原子核内有10个中子的氧原子:
18 8 |
| A、②③⑥ | B、①③⑤⑥ |
| C、③⑥ | D、①②③④⑤⑥ |
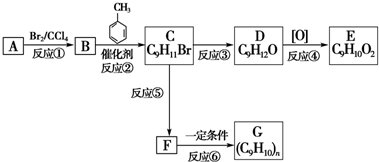
 ;
;

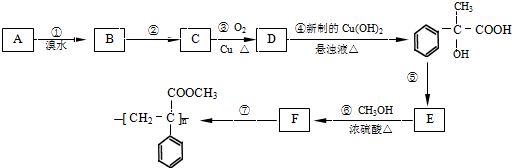
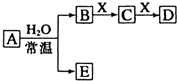 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).