题目内容
某化学小组以苯甲酸为原料,制取苯甲酸酯.已知有关物质的沸点如下表:
合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约为0.79g/cm3),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)简述混合液体时,最后加入浓硫酸的理由是 .若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式: .
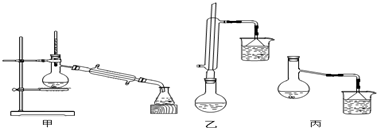
(2)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用 装置(填:甲、乙、丙).
(3)相对化学计量数之比,反应物甲醇应过量,其理由是 .
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 熔点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约为0.79g/cm3),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)简述混合液体时,最后加入浓硫酸的理由是

(2)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用
(3)相对化学计量数之比,反应物甲醇应过量,其理由是
考点:制备实验方案的设计
专题:
分析:(1)浓硫酸与苯甲酸、甲醇混合放出大量热量,硫酸的密度较大,甲醇易挥发;酯化反应机理为酸脱羟基醇脱氢,据此写出该反应的化学方程式;
(2)根据甲图、乙图装置的圆底烧瓶上没有冷凝管及甲醇易挥发进行分析;
(3)从甲醇沸点较低、价格较低、反应物浓度对化学平衡的影响方面分析.
(2)根据甲图、乙图装置的圆底烧瓶上没有冷凝管及甲醇易挥发进行分析;
(3)从甲醇沸点较低、价格较低、反应物浓度对化学平衡的影响方面分析.
解答:
解:(1)浓硫酸与苯甲酸、甲醇混合放出大量热量,硫酸的密度较大,最后加浓硫酸,放出的热量被溶液吸收,不会使溶液温度太高,导致甲醇挥发损失较多;苯甲酸与甲醇在浓硫酸作用下的酯化反应为:苯甲酸脱去羟基,据此脱去羟基中的氢原子,二者反应生成苯甲酸甲酯,所以水中18O原子来自苯甲酸,反应的化学方程式为:C6H5CO18OH+CH3OH C6H5COOCH3+H218O,
C6H5COOCH3+H218O,
故答案为:浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发;C6H5CO18OH+CH3OH C6H5COOCH3+H218O;
C6H5COOCH3+H218O;
(2)由装置图可知,乙图的圆底烧瓶上有冷凝管,充分起到回流作用,甲图和丙图则没有,而本题中反应物甲醇沸点低,苯甲酸、苯甲酸甲酯的沸点远高于甲醇,若采用甲图、丙图,甲醇必定会大量挥发,不利于合成反应,所以应冷凝回流,减少甲醇的挥发,提高产率,
故答案为:乙;
(3)由于该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇的量,可提高苯甲酸甲酯的转化率;
故答案为:该反应是可逆反应,增加CH3OH的量,使平衡向右移动,有利于提高苯甲酸的转化率.
 C6H5COOCH3+H218O,
C6H5COOCH3+H218O,故答案为:浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发;C6H5CO18OH+CH3OH
 C6H5COOCH3+H218O;
C6H5COOCH3+H218O;(2)由装置图可知,乙图的圆底烧瓶上有冷凝管,充分起到回流作用,甲图和丙图则没有,而本题中反应物甲醇沸点低,苯甲酸、苯甲酸甲酯的沸点远高于甲醇,若采用甲图、丙图,甲醇必定会大量挥发,不利于合成反应,所以应冷凝回流,减少甲醇的挥发,提高产率,
故答案为:乙;
(3)由于该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇的量,可提高苯甲酸甲酯的转化率;
故答案为:该反应是可逆反应,增加CH3OH的量,使平衡向右移动,有利于提高苯甲酸的转化率.
点评:本题通过苯甲酸甲酯的制备方法,考查了物质制备方案的设计与评价,题目难度中等,明确物质的制备原理为解答此类题的关键,该题为乙酸乙酯的制备知识的迁移题目,充分考查了学生灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为34,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数; A与C,B与D均为同主族元素.下列叙述正确的是( )
| A、B、D的最高价氧化物都不能和酸反应 |
| B、最高价氧化物对应的水化物的碱性:A>C |
| C、A的原子半径为这四种当中最小的 |
| D、四种元素中B形成化合物的种类最多 |
下列说法正确的是( )
| A、0.01mol/L的Na2HPO4溶液中存在如下的平衡;HPO42-?H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小 |
| B、饱和NH4Cl中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3?H2O)+c(OH-) |
| C、常温下,0.1mol/L的HA和BOH两种溶液,其pH值分别为3和12,将两溶液等体积混合后,所得溶液的pH≤7 |
| D、在NH4HSO3与NH4Cl混合溶液中:c(NH4+)=c(SO32-)+c(HSO3-)+c(H2SO3)+c(Cl-) |
下列说法正确的是( )
| A、元素的非金属性越强,它的氧化物的水化物的酸性就越强 |
| B、同一主族元素的原子序数可以相差34 |
| C、硅和硫熔化时所克服的作用类型相同 |
| D、分子晶体中分子间作用力越大,沸点越高,分子越稳定 |
 工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表: