题目内容
18.表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:(除特别注明外,其它一律用化学式表示)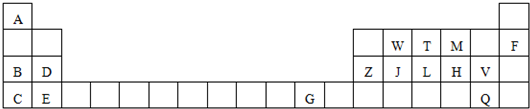
(1)化学性质最不活泼的单质是Ne,最高价氧化物水化物中碱性最强的是KOH.
(2)属于过渡元素的是G(填字母),J在周期表中的位置第三周期第ⅣA族.
(3)某元素二价阳离子的核外有10个电子,该元素是镁(填元素名称)
(4)M、H形成的气态氢化物的沸点比较:H2O>H2S
(5)Z、J、W三种元素中,较为常见的、适合作半导体材料的是Si,元素J、W的最高价氧化物形成的固体中,熔点较高的是SiO2(填化学式),判断的理由是SiO2是原子晶体,CO2是分子晶体,一般原子晶体熔点高于分子晶体(请用文字表述).
(6)C、B、D形成的阳离子半径由大到小的顺序K+>Na+>Mg2+.
(7)写出工业合成T的气态氢化物的化学方程式:N2+3H2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$2NH3.
分析 由元素在周期表的位置可知,A为H,B为Na,C为K,D为Mg,E为Ca,F为Ne,G为Cu,Z为Al,W为C,J为Si,T为N,L为P,M为O,H为S,V为Cl,Q为Br,由此分析解答.
解答 解:(1)化学性质最不活泼的单质是稀有气体氖,最高价氧化物水化物中碱性最强的是金属性最强的钾对应的氢氧化钾,故答案为:Ne;KOH;
(2)属于过渡元素的是铜,字母为G,硅在周期表中的位置第三周期第ⅣA族,故答案为:三;ⅣA;
(3)镁二价阳离子的核外有10个电子,该元素是镁,故答案为:镁;
(4)O、S形成的气态氢化物,水分间存在氢键,其沸点高,故答案为:H2O>H2S;
(5)铝、硅、碳三种元素中,较为常见的、适合作半导体材料的是硅,元素Si、C的最高价氧化物形成的固体中,二氧化硅是原子晶体熔点较高,判断的理由是SiO2是原子晶体,CO2是分子晶体,一般原子晶体熔点高于分子晶体,故答案为:Si;SiO2;SiO2是原子晶体,CO2是分子晶体,一般原子晶体熔点高于分子晶体;
(6)K、Na、Mg形成的阳离子,电子层数越多半径越大,电子层相同核电荷数越多半径越小,所以半径由大到小的顺序K+>Na+>Mg2+,故答案为:K+>Na+>Mg2+;
(7)工业上用氮气和氢气在高温 高压、催化剂条件下反应生成氨气,反应的化学方程式为:N2+3H2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$2NH3,
故答案为:N2+3H2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$2NH3.
点评 本题考查位置、结构、性质的关系及应用,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 标准状况下,33.6 L SO3分子含有的硫原子数为1.5NA | |
| B. | 1 mol/L KI溶液中I-数目为NA | |
| C. | 0.1 mol Na+离子中所含的电子数为3.4 NA | |
| D. | 56g铁与足量的Cl2或S反应时转移电子数均为3 NA |
| A. | CH3CH2CH2CH2Cl | B. | CH3CH2Cl | C. | CH3Br | D. | 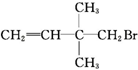 |
 在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )| A. | ①加CCl4 ②加苯 ③加酒精 | B. | ①加酒精 ②加CCl4 ③加苯 | ||
| C. | ①加苯 ②加CCl4 ③加酒精 | D. | ①加苯 ②加酒精 ③加CCl4 |


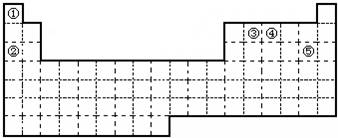
 ,试比较②和③原子半径的大小②>③(填“>”或“<”)
,试比较②和③原子半径的大小②>③(填“>”或“<”)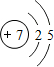 ,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)HNO3.
,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)HNO3.