题目内容
10.下列反应或说明了浓硫酸具哪些性质有?A.浓硫酸干燥气体时吸水性
B.CuSO4•5H2O$\frac{\underline{\;浓H_{2}SO_{4}\;}}{\;}$CuSO4+5H2O吸水性
C.Cu+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑酸性、强氧化性
D.C6H12O6$\stackrel{浓H_{2}SO_{4}}{→}$6C+6H2O脱水性
E.C+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+2H2O+SO2↑强氧化性.
分析 A.浓硫酸具有吸水性可以做干燥剂;
B.浓硫酸具有吸水性,能够吸收晶体中结晶水;
C.依据铜与浓硫酸反应中硫元素化合价变化判断;
D.浓硫酸能够使有机物中氢、氧原子按照2:1比例脱掉生成水;
E.依据碳与浓硫酸反应中硫元素化合价变化判断.
解答 解:A.浓硫酸干燥气体时,体现浓硫酸吸水性;
故答案为:吸水性;
B.CuSO4•5H2O$\frac{\underline{\;浓H_{2}SO_{4}\;}}{\;}$CuSO4+5H2O,浓硫酸吸收五水硫酸铜中结晶水生成无水硫酸铜,体现浓硫酸吸水性;
故答案为:吸水性;
C.Cu+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,反应中硫酸中+6价的硫部分化合价降低,表现浓硫酸强的氧化性,部分浓硫酸中+6价硫不变,体现浓硫酸酸性的性质;
故答案为:酸性、强氧化性;
D.C6H12O6$\stackrel{浓H_{2}SO_{4}}{→}$6C+6H2O,浓硫酸使葡萄糖碳化,体现浓硫酸脱水性;
故答案为:脱水性;
E.C+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+2H2O+SO2↑,反应中浓硫酸中+6价硫全部化合价降低,浓硫酸只表现强的氧化性;
故答案为:强氧化性.
点评 本题考查浓硫酸的性质,熟悉浓硫酸有吸水性、脱水性、强氧化性是解答的关键,明确钝化发生氧化还原反应,题目难度不大,注意吸水性与脱水性的区别.

练习册系列答案
相关题目
16.下列化学式仅代表一种物质的是( )
| A. | CH4 | B. | C3H8 | C. | C4H10 | D. | C5H12 |
1.烃的含碳量随碳原子数的增加呈现的一定的递变规律,关于下图的说法错误的是( )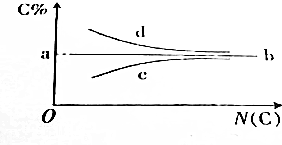

| A. | a点的值肯定是85.7% | B. | 满足b线走势的烃通式为CnH2n | ||
| C. | 满足c线走势的烃一定是烷烃 | D. | 满足d线走势的烃一定是炔烃 |
15.元素周期表的一部分,回答下列问题(用元素符号填写):
(1)分别写出①、③两种元素形成的高价态化合物的结构式O=C=O
(2)写出⑨的原子结构示意图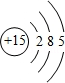 .
.
(3)在这些元素中,最活泼的金属元素的最高价氧化物对应水化物的电子式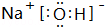 ,其溶于水时破坏的作用力为离子键
,其溶于水时破坏的作用力为离子键
(4)这些元素的最高价氧化物的对应水化物中酸性最强HClO4;形成的两性氢氧化物的化学式是Al(OH)3;上述两者反应的离子方程式Al(OH)3+3H+═Al3++3H2O
(5)从⑤到⑪的元素中,原子半径最小Cl.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)写出⑨的原子结构示意图
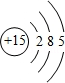 .
.(3)在这些元素中,最活泼的金属元素的最高价氧化物对应水化物的电子式
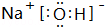 ,其溶于水时破坏的作用力为离子键
,其溶于水时破坏的作用力为离子键(4)这些元素的最高价氧化物的对应水化物中酸性最强HClO4;形成的两性氢氧化物的化学式是Al(OH)3;上述两者反应的离子方程式Al(OH)3+3H+═Al3++3H2O
(5)从⑤到⑪的元素中,原子半径最小Cl.
19.欲从苯酚的乙醇溶液中回收苯酚,有下列操作:①蒸馏,②过滤.③分液,④加入足量的金属钠,⑤通入过量的二氧化碳,⑥加入足量的氢氧化钠溶液,⑦加入足量的氯化铁溶液,⑧加入足量的浓溴水,⑨加入适量的盐酸.合理的步骤是( )
| A. | ⑧② | B. | ⑥①⑤③ | C. | ④⑤⑨ | D. | ⑦①③⑨ |
20.下列化学用语能正确表示相应意义的是( )
| A. | 丙烯的结构简式CH2CH2CH3 | B. | 四氯化碳的结构式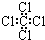 | ||
| C. | 丁烷的结构简式CH3(CH2)2CH3 | D. | 苯的分子式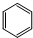 |
 酚
酚 羧酸
羧酸 醛
醛 卤代烃
卤代烃 酯.
酯.