题目内容
6.实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,制得的乙烯中混有CO2、SO2等杂质.某课外小组设计了如下装置,证明乙烯中混有CO2、SO2并验证乙烯的性质.回答下列问题:

(1)装置A是乙烯的发生装置.图中一处明显的错误是温度计水银球部分没有插入液面以下,烧瓶中碎瓷片的作用是防暴沸.
(2)若要检验A中所得气体含有SO2,可将混合合气体直接通入C(填代号,下同)装置;若要检验,A中所得气体含有CH2=CH2,可将混合气体先通入B装置,然后通入CD或CF或CG装置.
(3)写出实验室制取乙烯的化学方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
分析 证明乙烯中混有CO2、SO2并验证乙烯的性质,需要先检验二氧化硫的存在,再除去二氧化硫,检验二氧化硫是否除净,再用高锰酸钾溶液、溴水、溴的四氯化碳褪色证明乙烯的存在,
(1)温度计的位置取决于所测量的物质;乙醇沸点低,加热容易产生爆沸;
(2)二氧化硫具有漂白性,可以使品红溶液褪色;
依据乙烯不与氢氧化钠反应,二氧化硫能与氢氧化钠反应,乙烯具有还原性,能使酸性高锰酸钾褪色解答;
依据乙烯具有还原性能使溴的四氯化碳褪色,二氧化硫不与溴的四氯化碳反应的性质解答;
(3)在浓硫酸存在条件下加热到170℃,乙醇发生消去反应生成乙烯,据此写出反应的化学方程式.
解答 解:(1)浓硫酸和乙醇制取乙烯时,应严格控制反应物乙醇浓硫酸混合液的温度在170度,所以温度计测量的是混合液的稳定,温度计水银球部分没有插入液面以下;乙醇沸点低,加热时容易发生爆沸,加热碎瓷片可以防止爆沸,
故答案为:温度计水银球部分没有插入液面以下;防爆沸;
(2)若A中所得气体含有SO2,则通到盛有品红溶液的C中,可以使品红溶液褪色;
将混合气体先通入B,用氢氧化钠吸收生成的二氧化硫,然后通入装置C中品红检验二氧化硫是否除净,再通过盛有酸性的高锰酸钾的D装置,若高锰酸钾褪色则可证明乙烯的存在,或通过装置C后通过装置F、G都可以验证乙烯的存在,
故答案为:C;CD或CF或CG;
(3)实验室中通过乙醇的消去反应制取乙烯,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
点评 本题考查了性质实验方案的设计,题目难度中等,注意掌握乙醇发生消去反应原理及乙烯的实验室制法,试题侧重考查学生分析问题,设计实验的能力,明确各种气体的性质是本题解题的关键.

| A. | 2甲基丙烷 | B. | 2甲基丁烷 | C. | 2,2二甲基丙烷 | D. | 2,3二甲基丁烷 |
| A. | “玉兔”月球车上的太阳能电池的材料是硅酸盐 | |
| B. | 利用二氧化碳制造全降解塑料,可以消除温室效应 | |
| C. | 实验室镁着火时,可使用泡沫灭火器灭火 | |
| D. | 可使用氢氧化钠溶液鉴别大豆油与矿物油 |
| 试管编号 | 加3%Na2S2O3溶液/ml | 加H2O/ml | 加H2SO4(1:5)/滴 | 出现浑浊所用时间/s |
| ① | 3 | 3 | 5 | a |
| ② | 4 | 2 | 5 | b |
| ③ | 5 | 1 | 5 | c |
(2)实验结论:对于一个化学反应,在其他条件不变时,反应物的浓度越大,化学反应速率越大
(3)写出反应的化学方程式:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.
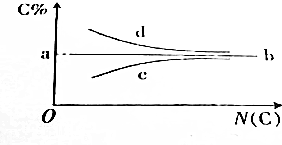
| A. | a点的值肯定是85.7% | B. | 满足b线走势的烃通式为CnH2n | ||
| C. | 满足c线走势的烃一定是烷烃 | D. | 满足d线走势的烃一定是炔烃 |
| A. | 乙烷和氯气取代 | B. | 乙烯和氢气加成后,在用氯气取代 | ||
| C. | 乙烯和氯化氢加成 | D. | 乙烯和氯气加成 |
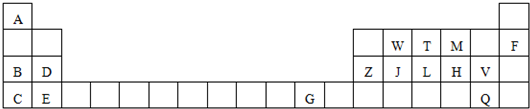
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)写出⑨的原子结构示意图
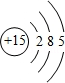 .
.(3)在这些元素中,最活泼的金属元素的最高价氧化物对应水化物的电子式
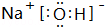 ,其溶于水时破坏的作用力为离子键
,其溶于水时破坏的作用力为离子键(4)这些元素的最高价氧化物的对应水化物中酸性最强HClO4;形成的两性氢氧化物的化学式是Al(OH)3;上述两者反应的离子方程式Al(OH)3+3H+═Al3++3H2O
(5)从⑤到⑪的元素中,原子半径最小Cl.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是K,最不活泼的元素是Ar.
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.