题目内容
4.[Cu(N4H3)4]x(SO4)y•zH2O是一种重要的染料及农药中间体,为深蓝色晶体.已知: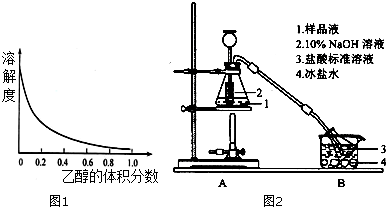
①[Cu(NH3)4]x(SO4)y•zH2O在在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线如图1.
②[Cu(NH3)4]x(SO4)y•zH2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]x(SO4)y•zH2O=x[Cu(NH3)4]2++y SO42-+z H2O
[Cu(NH3)4]2+?Cu2++4NH3
Ⅰ、某学习小组在实验室以废铜屑、稀硫酸、氨水为主要原料合成该物质,设计的合成路线为:
废铜屑$\stackrel{灼烧}{→}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$溶液A$\stackrel{氨水}{→}$悬浊液B$\stackrel{氨水}{→}$溶液C$\stackrel{试剂D}{→}$$\stackrel{操作E}{→}$产品品体
(1)一般废金属屑在使用之前需要用热的碱液浸泡以除去其表面的油污,但本实验并不需要的原因是灼烧时油污生成CO2和H2O而除去.
(2)依据相关信息试剂D为无水乙醇.若操作过程不加入试剂D而是加热蒸发、冷却结晶,则得到的产物晶体中往往含有Cu(OH)2[或Cu2(OH)2SO4]杂质,产生该杂质的原因是加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且Cu2+发生水解.
(3)操作E的实验步骤为:a.减压过滤 b.洗涤 c.干燥
①洗涤时不用水而用乙醇和浓氨水的混合物洗涤的原因为减少粗产品的溶解损耗.
②干燥时不宜采用加热干燥的方法,可能的原因是加热易使[Cu(NH3)4]SO4•H2O分解.
Ⅱ、NH3的测定:精确称取a g 晶体,加适量水溶解,注入如图2所示的锥形瓶中,然后逐滴加入足量10% NaOH溶液至小试管充满并溢出足够溶液,加热保持微沸,将样品溶液中的氨全部蒸出,用V1mLc1mol•L-1的盐酸溶液吸收.蒸氨结束后取下接收瓶,用c2 mol•L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mlNaOH溶液
(4)装置中长颈漏斗插入小试管的作用:液封并减少NaOH溶液的用量,可以控制反应的开始及速率作用同分液漏斗.
(5)蒸氨过程中锥形瓶内会出现少量黑色固体的化学式为CuO.氨完全蒸出的标志为溶液不再为深蓝色.
(6)样品中NH3的质量分数的表达式为$\frac{1.7({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{ag}$%.
(7)[Cu(NH3)4]x(SO4)y•zH2O晶体中硫酸根和水的质量分数分别为39.02%和7.32%,则晶体的化学式为[Cu(NH3)4]SO4•H2O.
分析 Ⅰ、实验室以废铜屑、稀硫酸、氨水为主要原料合成[Cu(NH3)4]x(SO4)y•zH2O,其合成路线为:将废铜屑灼烧生成CuO,再稀硫酸溶解得溶液A为硫酸铜溶液,在硫酸铜溶液中加氨水得悬浊液B为氢氧化铜悬浊液,继续加氨水形成铜氨配合离子,所以溶液C为[Cu(NH3)4]x(SO4)y溶液,在溶液C中加入乙醇,经减压过滤、洗涤、干燥得晶体,
(1)油污在灼烧时会生成二氧化碳和水而除去,不影响后续实验;
(2)晶体在乙醇溶液中溶解度会减小,铜离子水解,加热后氨气挥发,会促使铜离子水解生成氢氧化铜;
(3)用乙醇和浓氨水的混合物洗涤晶体,可以减少晶体的损失,[Cu(NH3)4]SO4•H2O受热易分解,所以不宜用加热的方法干燥;
Ⅱ、NH3的测定:将晶体溶于水,加入足量的氢氧化钠溶液,加热,使氨气逸出,用一定量 的盐酸吸收,再用氢氧钠溶液测定未反应的盐酸,根据与氨气反应的盐酸可计算出逸出的氨气的物质的量,
(4)装置中长颈漏斗插入小试管起液封的作用,可以防止氨气跑到空气中,同时可以减少NaOH溶液的用量,可以控制反应的开始及速率作用同分液漏斗;
(5)蒸氨过程中锥形瓶内铜离子水解生成氢氧化铜,氢氧化铜受热分解生成氧化铜;铜氨配合离子的溶液呈深蓝色,而铜离子的水溶液呈蓝色,据此判断;
(6)根据题意,用于滴定盐酸的氢氧化钠的物质的量为c2 mol•L-1×V2 ml,则与氨气反应的盐酸的物质的量为V1mL×c1mol•L-1-c2 mol•L-1×V2 ml,据此可求得样品中NH3的质量,再结合样品的质量可求得氨气的分数;
(7)[Cu(NH3)4]x(SO4)y•zH2O晶体中硫酸根和水的质量分数分别为39.02%和7.32%,可得方程组$\left\{\begin{array}{l}{\frac{96y}{132x+96y+18z}=39.02%}\\{\frac{18z}{132x+96y+18z}=7.32%}\end{array}\right.$,根据方程组可确定x:y:z的值,进而确定晶体的化学式;
解答 Ⅰ、实验室以废铜屑、稀硫酸、氨水为主要原料合成[Cu(NH3)4]x(SO4)y•zH2O,其合成路线为:将废铜屑灼烧生成CuO,再稀硫酸溶解得溶液A为硫酸铜溶液,在硫酸铜溶液中加氨水得悬浊液B为氢氧化铜悬浊液,继续加氨水形成铜氨配合离子,所以溶液C为[Cu(NH3)4]x(SO4)y溶液,在溶液C中加入乙醇,经减压过滤、洗涤、干燥得晶体,
(1)油污在灼烧时会生成二氧化碳和水而除去,不影响后续实验,所以但本实验并不需要用热的碱液浸泡以除去其表面的油污,
故答案为:灼烧时油污生成CO2和H2O而除去;
(2)晶体在乙醇溶液中溶解度会减小,所以试剂D为乙醇,若操作过程不加入试剂D而是加热蒸发、冷却结晶,则铜离子水解,加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且Cu2+发生水解,会生成Cu(OH)2[或Cu2(OH)2SO4],所以会有杂质Cu(OH)2[或Cu2(OH)2SO4],
故答案为:无水乙醇;Cu(OH)2[或Cu2(OH)2SO4];加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且Cu2+发生水解;
(3)用乙醇和浓氨水的混合物洗涤晶体,可以减少晶体的损失,[Cu(NH3)4]SO4•H2O受热易分解,所以不宜用加热的方法干燥,
故答案为:①减少粗产品的溶解损耗;②加热易使[Cu(NH3)4]SO4•H2O分解;
Ⅱ、NH3的测定:将晶体溶于水,加入足量的氢氧化钠溶液,加热,使氨气逸出,用一定量 的盐酸吸收,再用氢氧钠溶液测定未反应的盐酸,根据与氨气反应的盐酸可计算出逸出的氨气的物质的量,
(4)装置中长颈漏斗插入小试管起液封的作用,可以防止氨气跑到空气中,同时可以减少NaOH溶液的用量,可以控制反应的开始及速率作用同分液漏斗,
故答案为:液封并减少NaOH溶液的用量,可以控制反应的开始及速率作用同分液漏斗;
(5)蒸氨过程中锥形瓶内铜离子水解生成氢氧化铜,氢氧化铜受热分解生成氧化铜,化学式为CuO,铜氨配合离子的溶液呈深蓝色,而铜离子的水溶液呈蓝色,所以氨完全蒸出的标志为 溶液不再为深蓝色,
故答案为:CuO;溶液不再为深蓝色;
(6)根据题意,用于滴定盐酸的氢氧化钠的物质的量为c2 mol•L-1×V2 ml,则与氨气反应的盐酸的物质的量为V1mL×c1mol•L-1-c2 mol•L-1×V2 mL,所以样品中NH3的质量为17g/mol×(V1L×c1mol•L-1-c2 mol•L-1×V2 L)×10-3=0.017(c1V1-c2 V2 )g,样品中氨气的分数为$\frac{0.017({{{c}_{\;}}_{1}}_{\;}{V}_{1}-c{\;}_{2}{V}_{2})g}{ag}$×100%=$\frac{1.7({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{ag}$%,
故答案为:$\frac{1.7({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{ag}$%;
(7)[Cu(NH3)4]x(SO4)y•zH2O晶体中硫酸根和水的质量分数分别为39.02%和7.32%,可得方程组$\left\{\begin{array}{l}{\frac{96y}{132x+96y+18z}=39.02%}\\{\frac{18z}{132x+96y+18z}=7.32%}\end{array}\right.$,根据方程组知x:y:z=1:1:1,所以晶体的化学式为[Cu(NH3)4]SO4•H2O,
故答案为:[Cu(NH3)4]SO4•H2O.
点评 本题考查物质的制备,涉及化学平衡移动、结晶方式的分析、化学计算等,弄清实验原理、目的、要求、步骤和注意事项是解题的关键,中等难度.

 阅读快车系列答案
阅读快车系列答案| A. | HF的电离平衡正向移动,c(H+)增大 | |
| B. | HF的电离程度增大,c(H+)、c(F-)增大,c(HF)减小 | |
| C. | 稀释过程中,c(OH-)增大 | |
| D. | 溶液的KW、pH均不变 |

 将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol/L盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).已知:①加入固体A的质量m≤3.2g时,收集到的气体为H2;②当m>3.2g时,收集到的气体为H2和H2S的混合气体.
将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol/L盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).已知:①加入固体A的质量m≤3.2g时,收集到的气体为H2;②当m>3.2g时,收集到的气体为H2和H2S的混合气体. .
.