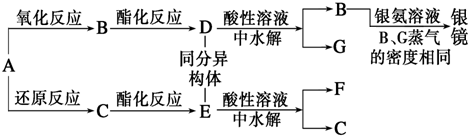
题目内容
16.按要求完成下列填空:(1)在元素周期表中电负性最大的元素符号F;短周期中第一电离能最小的元素基态原子核外电子排布式1s22s22p63s1;第三周期原子半径最小的元素的价电子排布式3s23p5.
(2)已知下列化学键的键能:Si-O:46OkJ/mo1,Si-Si:175kJ/mo1,O═O:498k1/mol,则反应Si+O2═SiO2的反应的△H=-992KJ/mol.
(3)N≡N的键能为942kJ/mo1,N-N单键的键能为247kJ/mo1,通过计算说明N2中的π键更稳定(填“σ”或“π”).
(4)钋(Po)是一种放射性金属,它的晶胞堆积模型为简单立方堆积,钋的摩尔质量为209g•mol-1,晶胞的密度为ρ g•cm-3,则它晶胞的边长(a)为$\root{3}{\frac{209}{ρ{N}_{A}}}$×1010pm.(用代数式表示,NA表示阿伏加德罗常数)

(5)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图2所示,该晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则$\frac{m}{n}$=4.
分析 (1)根据非金属性越强电负性越强来判断;元素的第一电离能是指气态原子失去1个电子形成气态阳离子克服原子核的引力而消耗的能量,原子越易电子其第一电离能越小;同周期从左到右原子半径依次减小;
(2)根据△H=反应物键能之和-生成物键能之和计算;
(3)N≡N中含有2个π键,1个σ键,根据已知数据计算判断;
(4)根据晶胞中原子数目计算结合摩尔质量,计算晶胞质量,再根据密度定义计算晶胞的体积,求边长;
(5)以顶点为计算,与之相邻的最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,然后求出比值.
解答 解:(1)根据非金属性越强电负性越强,周期表中非金属性最强的为F,所以F的电负性最大;元素的第一电离能是指气态原子失去1个电子形成气态阳离子克服原子核的引力而消耗的能量,原子越易电子其第一电离能越小,短周期中Na原子最易失去1个电子,所以Na的第一电离能最小,Na的电子排布式为1s22s22p63s1;同周期从左到右原子半径依次减小,所以第三周期原子半径最小的元素为Cl,其价电子排布式为3s23p5;
故答案为:F;1s22s22p63s1;3s23p5;
(2)根据晶体结构可知,在晶体硅中每个硅原子实际占有2个Si-Si键,在二氧化硅中每个硅原子占有4个Si-O键,所以△H=反应物键能之和-生成物键能之和可得,△H=(175×2+498-4×460)KJ/mol=-992KJ/mol;
故答案为:-992KJ/mol;
(3)N≡N中含有2个π键,1个σ键,已知N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol,则1个π键的键能为$\frac{942-247}{2}$kJ/mol=347.5kJ/mol,则N2中的π键键能大于σ键键能,较稳定,
故答案为:π;
(4)晶胞的堆积棋型为简单立方堆积,则晶胞中含有1个原子,故晶胞质量为$\frac{209}{{N}_{A}}$g,晶胞的体积为V=a3cm3,故晶胞密度ρ=$\frac{m}{V}$=$\frac{\frac{209}{{N}_{A}}g}{{a}^{3}c{m}^{3}}$,解得a=$\root{3}{\frac{209}{ρ{N}_{A}}}$cm=$\root{3}{\frac{209}{ρ{N}_{A}}}$×1010pm,
故答案为:$\root{3}{\frac{209}{ρ{N}_{A}}}$×1010;
(5)与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则$\frac{m}{n}$=$\frac{12}{4}$=3;
故答案为:3.
点评 本题考查了电负性、化学键的稳定性判断以及晶胞的计算等知识点,注意根据均摊法计算晶胞中原子数目,计算晶胞的棱长是计算的关键,题目难度中等,侧重于考查学生的分析能力和计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | Fe(OH)3 | B. | Fe(OH)2 | C. | FeCl2 | D. | Fe(NO3)2 |
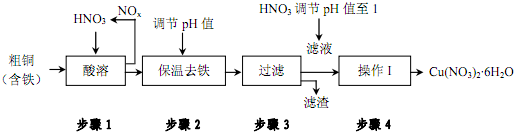
(1)步骤1中向装置内通入氧气可提高原料转化率、减少空气污染.用化学用语解释其原因氮氧化物和氧气、水反应生成硝酸,从而减少氮氧化物的排放,则降低空气污染
(2)步骤2中
①调节pH值为使Fe3+沉淀完全,可以向溶液中加入cd(填字母).
a.NaOH溶液 b.氨水 c.Cu(OH)2 d.CuO
②根据下表数据,溶液的 pH应保持在3.2≤pH值<4.7范围
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(4)在硝酸铜溶液中,各种离子浓度由大到小的顺序是c(NO3-)>c(Cu2+)>c(H+)>c(OH-).
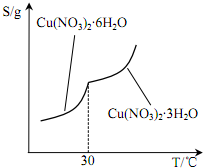
(5)步骤4的操作I应该为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
根据不同硝酸铜晶体的溶解度曲线(如图所示)该操作温度应控制在 25~30℃,原因为温度高于30℃时,Cu(NO3)2•6H2O水生成Cu(NO3)2•3H2O.
| A. | 按系统命名法,化合物 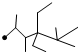 的名称是 2,3,5,5-四甲基-4,4-二乙基己烷 的名称是 2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段为 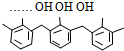 …的高聚物,其单体是甲醛和苯酚 …的高聚物,其单体是甲醛和苯酚 |
(1)元素的性质特别是化学性质取决于元素原子结构.钠离子的电子式为Na+,铝元素的原子结构示意图为
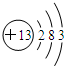 .
.(2)钠、镁、铝元素的阳离子半径由小到大的顺序是Al3+<Mg2+<Na+(用离子符号表示).在短周期中非金属性最强的元素位于第二周期第VIIA族.
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律.下列有关说法正确的是b、d(选填编号).
a.元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小.Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性.第三周期主族元素的电负性如下:
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
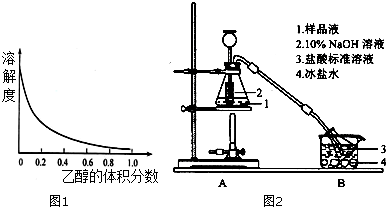
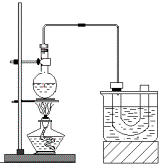 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)