题目内容
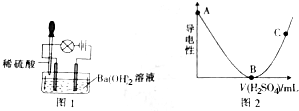
8.为了探究溶液导电性与离子浓度的关系,某课题小组设计了如下实验:取一定量Ba(OH)2溶液做导电性实验,往烧杯中滴加稀硫酸,装置如图1.测得溶液导电程度如图2所示.
(1)根据组成分类,将盐分为正盐(如Na2SO4)、酸式盐(如NaHCO3)、碱式盐[如碱式碳酸铜Cu2(OH)2CO3等].NaHSO4属于AC(填字母).
A.钠盐 B.含氧酸
C.酸式盐 D.氧化物
(2)往烧杯中滴加稀硫酸的过程中,观察到灯泡变化:亮→暗→熄→亮,还可观察到的现象有出现白色沉淀.
(3)图2中,AB段变化的原因是硫酸和氢氧化钡之间反应生成难电离的硫酸钡和水,使溶液中自由离子浓度逐渐减小,直到反应完全,溶液中几乎没有自由离子;BC段变化的原因是加硫酸时,溶液中自由离子浓度又开始逐渐增大.
(4)写出A→B过程中发生反应的离子方程式Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
分析 (1)NaHSO4在水溶液中电离出钠离子和氢离子、硫酸根离子,据此回答;
(2)H2SO4和Ba(OH)2反应会出现白色沉淀,据此回答;
(3)硫酸和氢氧化钡之间反应生成难电离的硫酸钡和水,使溶液中自由离子浓度逐渐减小,直到反应完全,溶液中几乎没有自由离子,再加硫酸时,溶液中自由离子浓度又开始逐渐增大;
(4)硫酸和氢氧化钡之间反应生成难电离的硫酸钡和水,据此回答.
解答 解:(1)NaHSO4在水溶液中电离出钠离子和氢离子、硫酸根离子,属于盐中的钠盐,也可是说是含氧酸盐,酸式盐,故选AC.
(2)H2SO4和Ba(OH)2反应会出现白色沉淀,故答案为:出现白色沉淀;
(3)硫酸和氢氧化钡之间反应生成难电离的硫酸钡和水,使溶液中自由离子浓度逐渐减小,直到反应完全,溶液中几乎没有自由离子,出现亮→暗→熄的现象,再加硫酸时,溶液中自由离子浓度又开始逐渐增大;故答案为:硫酸和氢氧化钡之间反应生成难电离的硫酸钡和水,使溶液中自由离子浓度逐渐减小,直到反应完全,溶液中几乎没有自由离子;加硫酸时,溶液中自由离子浓度又开始逐渐增大.
(4)硫酸和氢氧化钡之间反应生成难电离的硫酸钡和水,发生反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
点评 本题考查离子反应及导电性实验,注意发生的离子反应及溶液中离子浓度与导电性的关系即可解答,题目难度不大.

练习册系列答案
相关题目
18.下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
| A. | C(s)+O2(g)=CO2(g)△H=+110.5 kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.31 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol | |
| D. | 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-11036 kJ/mol |
3.15.6g Na2O2放入水中充分反应将产生的气体与铜和铁的混合物11.2g恰好完全反应,将所得氧化铜、氧化铁用足量CO还原,理论上最少需标准状况下CO的体积为( )
| A. | 1.12L | B. | 2.24L | C. | 3.36L | D. | 4.48L |
11.工业上制备 Cu(NO3)2•6H2O的流程如下:
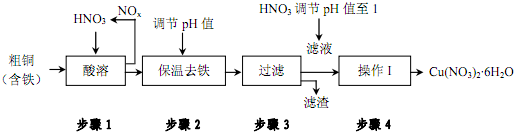
(1)步骤1中向装置内通入氧气可提高原料转化率、减少空气污染.用化学用语解释其原因氮氧化物和氧气、水反应生成硝酸,从而减少氮氧化物的排放,则降低空气污染
(2)步骤2中
①调节pH值为使Fe3+沉淀完全,可以向溶液中加入cd(填字母).
a.NaOH溶液 b.氨水 c.Cu(OH)2 d.CuO
②根据下表数据,溶液的 pH应保持在3.2≤pH值<4.7范围
(3)步骤3中,要用硝酸调节溶液的pH=1,应用平衡原理解释其原因为硝酸铜水解生成氢氧化铜和硝酸,加入硝酸抑制硝酸铜水解,得到较纯净的Cu(NO3)2•6H2O
(4)在硝酸铜溶液中,各种离子浓度由大到小的顺序是c(NO3-)>c(Cu2+)>c(H+)>c(OH-).
(5)步骤4的操作I应该为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
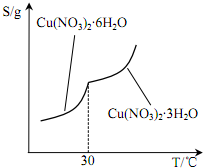
根据不同硝酸铜晶体的溶解度曲线(如图所示)该操作温度应控制在 25~30℃,原因为温度高于30℃时,Cu(NO3)2•6H2O水生成Cu(NO3)2•3H2O.

(1)步骤1中向装置内通入氧气可提高原料转化率、减少空气污染.用化学用语解释其原因氮氧化物和氧气、水反应生成硝酸,从而减少氮氧化物的排放,则降低空气污染
(2)步骤2中
①调节pH值为使Fe3+沉淀完全,可以向溶液中加入cd(填字母).
a.NaOH溶液 b.氨水 c.Cu(OH)2 d.CuO
②根据下表数据,溶液的 pH应保持在3.2≤pH值<4.7范围
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(4)在硝酸铜溶液中,各种离子浓度由大到小的顺序是c(NO3-)>c(Cu2+)>c(H+)>c(OH-).
(5)步骤4的操作I应该为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
根据不同硝酸铜晶体的溶解度曲线(如图所示)该操作温度应控制在 25~30℃,原因为温度高于30℃时,Cu(NO3)2•6H2O水生成Cu(NO3)2•3H2O.

8.钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切.
(1)元素的性质特别是化学性质取决于元素原子结构.钠离子的电子式为Na+,铝元素的原子结构示意图为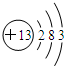 .
.
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是Al3+<Mg2+<Na+(用离子符号表示).在短周期中非金属性最强的元素位于第二周期第VIIA族.
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律.下列有关说法正确的是b、d(选填编号).
a.元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小.Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性.第三周期主族元素的电负性如下:
从上表可以看出电负性的大小与元素非金属性的强弱关系是元素的电负性越大,其非金属性越强;大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律,AlCl3中的化学键类型应该是共价键.
(1)元素的性质特别是化学性质取决于元素原子结构.钠离子的电子式为Na+,铝元素的原子结构示意图为
 .
.(2)钠、镁、铝元素的阳离子半径由小到大的顺序是Al3+<Mg2+<Na+(用离子符号表示).在短周期中非金属性最强的元素位于第二周期第VIIA族.
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律.下列有关说法正确的是b、d(选填编号).
a.元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小.Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性.第三周期主族元素的电负性如下:
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
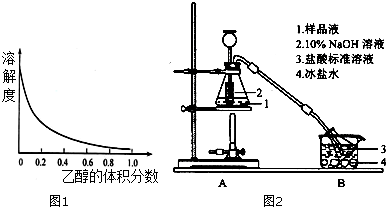
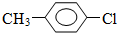
 ,其生产过程如图所示(反应条件未全部注明):
,其生产过程如图所示(反应条件未全部注明):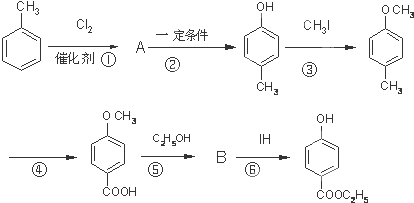
 .
. +CH3I→
+CH3I→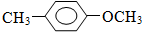 +HI
+HI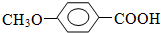 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$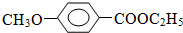 C2H5OH+H2O
C2H5OH+H2O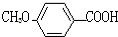 的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式
的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式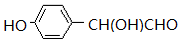 .
.