题目内容
1.常温下,纯水中存在电离平衡:H2O?H++O H-,①若要使水的电离平衡向正反应方向移动,并使溶液中的c(OH-)增加,应加入的物质是C
A.HCl B.NH4Cl C.Na2CO3 D.NaOH
②在0.1mol/LNH4Cl溶液中,离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),溶液显酸性(填“酸”“碱”“中”),用离子方程式表示NH4Cl溶液显酸性的原因NH4++H2O?NH3•H2O+H+.
分析 ①酸、碱或强酸酸式盐能抑制水电离,含有弱离子的盐促进水电离;欲使水的电离平衡向正方向移动,并使c(H+)增大,可加入能水解生成酸性的盐,以此解答该题;
②氯化铵溶液中铵根离子水解溶液显酸性;
解答 解:①A.HCl 溶于水氢离子浓度增大,抑制水的电离平衡,故A错误;
B.NH4Cl 溶于水,溶液中铵根离子水解促进水的电离,溶液显酸性,故B错误;
C.Na2CO3 溶液中碳酸根离子水解促进水的电离平衡正向进行,溶液中氢氧根离子浓度增大,故C正确;
D.NaOH溶于水抑制水的电离平衡,氢氧根离子浓度增大,故D错误;
故答案为:C;
②在0.1mol/LNH4Cl溶液中,铵根离子水解溶液显酸性,离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),离子方程式为:NH4++H2O?NH3•H2O+H+,
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-); 酸;NH4++H2O?NH3•H2O+H+;
点评 本题以盐类水解为载体考查水的电离,题目难度中等,明确影响水电离因素是解本题关键,知道常见盐的类型及其溶液酸碱性,易错选项是A,注意硫酸氢钠溶液相当于强酸溶液.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
| A. | 氯化钠可用作调味剂 | |
| B. | Na2O常用于潜水艇或呼吸面具的供氧剂 | |
| C. | 明矾可用作净水剂 | |
| D. | FeCl3溶液可用于刻制印刷铜电路板 |
12.一种有机玻璃的结构简式为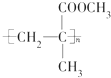 .下列关于它的叙述中不正确的是( )
.下列关于它的叙述中不正确的是( )
 .下列关于它的叙述中不正确的是( )
.下列关于它的叙述中不正确的是( )| A. | 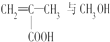 在一定条件下发生缩聚反应即可合成该有机玻璃 在一定条件下发生缩聚反应即可合成该有机玻璃 | |
| B. | 该有机玻璃能发生氧化反应 | |
| C. | 合成该有机玻璃的原料可能有甲烷 | |
| D. | 它在一定条件下发生水解反应时C-O键断裂 |
6.室温下进行的下列实验,不能达到预期目的是序号( )
| 序号 | 实验内容 | 实验目的 |
| A | 测定NaClO溶液,CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向Mg(OH)2浊液中滴加少量0.1mol/LFeCl3溶液 | 比较Mg(OH)2和Fe(OH)3的溶解度 |
| C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对化学平衡状态的影响 |
| D | 向两只同体积同浓度的K2Cr2O7溶液中,分别加入1mL同浓度的H2SO4、NaOH溶液 | 探究浓度对该化学平衡状态的影响 |
| A. | A | B. | B | C. | C | D. | D |
1.下列说法正确的是( )
| A. | 按系统命名法,化合物 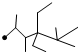 的名称是 2,3,5,5-四甲基-4,4-二乙基己烷 的名称是 2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段为 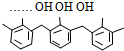 …的高聚物,其单体是甲醛和苯酚 …的高聚物,其单体是甲醛和苯酚 |