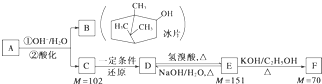
题目内容
在0.1mol/L的氨水中,存在如下电离平衡:NH3?H2O?NH4++OH-(正反应为吸热反应).在此平衡体系中,若按下列情况变动,请将变化情况(增大用“↑”,减小用“↓”,向左用“←”,向右用“→”)填入下表.
| 条件的变化 | 升温 | 通氨气 | 加水 | 加NaOH(s) | 加NH4Cl(s) | 通CO2 |
| 电离平衡移动的方向 | ||||||
| n(OH-) | ||||||
| c(OH-) | ||||||
| c(NH3?H2O) | ||||||
| 导电能力 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:氨水中存在电离平衡,如果向氨水中加入含有铵根离子或氢氧化根离子的物质,则抑制氨水电离,如果加入和铵根离子或氢氧根离子反应的物质则促进其电离,据此分析解答;
解答:
解:升温电离是吸热反应,所以电离平衡正向移动,n(OH-)增大,c(OH-)增大;c(NH3?H2O)减小,导电能力增大;
通氨气,一水合氨的浓度变大,电离平衡正向移动,n(OH-)增大,c(OH-)增大,c(NH3?H2O)增大,导电能力增大;
加水促进电离,平衡正向移动,n(OH-)增大,c(OH-)减小,c(NH3?H2O)减小,导电能力减弱;
加NaOH(s),导致氢离子的浓度减小,电离平衡逆向移动,n(OH-)增大,c(OH-)增大,c(NH3?H2O)增大,导电能力增大;
加NH4Cl(s),铵根离子浓度变大,电离平衡逆向移动,n(OH-)减小,c(OH-)减小,c(NH3?H2O)增大,导电能力增大;
通CO2氢氧根离子浓度减小,电离平衡下正向移动,n(OH-)减小,c(OH-)减小,c(NH3?H2O)减小,导电能力增大;
故答案为:
.
通氨气,一水合氨的浓度变大,电离平衡正向移动,n(OH-)增大,c(OH-)增大,c(NH3?H2O)增大,导电能力增大;
加水促进电离,平衡正向移动,n(OH-)增大,c(OH-)减小,c(NH3?H2O)减小,导电能力减弱;
加NaOH(s),导致氢离子的浓度减小,电离平衡逆向移动,n(OH-)增大,c(OH-)增大,c(NH3?H2O)增大,导电能力增大;
加NH4Cl(s),铵根离子浓度变大,电离平衡逆向移动,n(OH-)减小,c(OH-)减小,c(NH3?H2O)增大,导电能力增大;
通CO2氢氧根离子浓度减小,电离平衡下正向移动,n(OH-)减小,c(OH-)减小,c(NH3?H2O)减小,导电能力增大;
故答案为:
| 条件的变化 | 升温 | 通氨气 | 加水 | 加NaOH(s) | 加NH4Cl(s) | 通CO2 |
| 电离平衡移动的方向 | → | → | → | ← | ← | → |
| n(OH-) | ↑ | ↑ | ↑ | ↑ | ↓ | ↓ |
| c(OH-) | ↑ | ↑ | ↓ | ↑ | ↓ | ↓ |
| c(NH3?H2O) | ↓ | ↑ | ↓ | ↑ | ↑ | ↓ |
| 导电能力 | ↑ | ↑ | ↓ | ↑ | ↑ | ↑ |
点评:本题考查弱电解质电离,加入相同的离子则抑制弱电解质电离,加入和溶液中离子反应的物质则促进其电离,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列分离和提纯的实验操作中,正确的是( )


| A、蒸发 | B、过滤 | C、蒸馏 | D、分液 |
重水(2H2O)是重要的核工业原料,下列说法不正确的是( )
A、氘(
| ||||
B、
| ||||
| C、1H2O与2H2O是同一种物质 | ||||
| D、1H218O与2H216O的相对分子质量相同 |
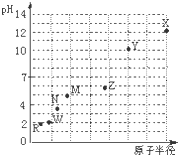 第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )
第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )| A、气态氢化物的稳定性:M>N |
| B、Z的最高价氧化物对应的水化物能溶于稀氨水 |
| C、X和W形成的常见化合物阴阳离子个数比为1:2 |
| D、Z和R组成的化合物是弱电解质 |
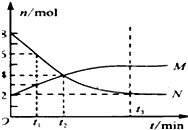 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:N?2M |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、平衡时,N的转化率是75% |
| D、t1分钟内,反应速率:v(M)=2v(N) |
共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用,含有上述中两种相互作用的晶体是( )
| A、SiO2晶体 |
| B、Ar晶体 |
| C、NaCl晶体 |
| D、NaOH晶体 |