题目内容
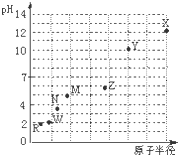 第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )
第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )| A、气态氢化物的稳定性:M>N |
| B、Z的最高价氧化物对应的水化物能溶于稀氨水 |
| C、X和W形成的常见化合物阴阳离子个数比为1:2 |
| D、Z和R组成的化合物是弱电解质 |
考点:同一周期内元素性质的递变规律与原子结构的关系
专题:
分析:元素的金属性越强,其对应最高价氧化物的水化物碱性越强则该溶液的pH越大,元素的非金属性越强,其最高价氧化物的水化物酸性越强则该溶液的pH越小,根据图象知,从R到X,最高价氧化物的水化物碱性逐渐增强、酸性逐渐减弱,X、Y、Z、M、N、W、R分别为Na、Mg、Al、Si、P、S、Cl元素.
解答:
解:元素的金属性越强,其对应最高价氧化物的水化物碱性越强则该溶液的pH越大,元素的非金属性越强,其最高价氧化物的水化物酸性越强则该溶液的pH越小,根据图象知,从R到X,最高价氧化物的水化物碱性逐渐增强、酸性逐渐减弱,X、Y、Z、M、N、W、R分别为Na、Mg、Al、Si、P、S、Cl元素.
A.元素的非金属性越强,其氢化物越稳定,P的非金属性大于Si,则气态氢化物的稳定性:N>M,故A错误;
B.Z的最高价氧化物对应的水化物是氢氧化铝,氢氧化铝能溶于强碱但不能溶于弱碱,所以不能溶于稀氨水,故B错误;
C.X是钠和W是硫形成的常见化合物是硫化钠,阴阳离子个数比为1:2,故C正确;
D.Z是铝和R是氯,组成的化合物氯化铝是强电解质,故D错误;
故选C.
A.元素的非金属性越强,其氢化物越稳定,P的非金属性大于Si,则气态氢化物的稳定性:N>M,故A错误;
B.Z的最高价氧化物对应的水化物是氢氧化铝,氢氧化铝能溶于强碱但不能溶于弱碱,所以不能溶于稀氨水,故B错误;
C.X是钠和W是硫形成的常见化合物是硫化钠,阴阳离子个数比为1:2,故C正确;
D.Z是铝和R是氯,组成的化合物氯化铝是强电解质,故D错误;
故选C.
点评:本题考查了同一周期元素性质递变规律,明确元素最高价氧化物的水化物酸碱性是解本题关键,再结合化合物的构成、性质来分析解答,易错选项是C,注意:氯化镁中两个氯离子之间不存在化学键,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某中性有机物C8H16O2在稀硫酸作用下加热得到M和N两种物质,N经氧化最终可得到M,则该中性有机物的结构可能有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
Al2O3是刚玉的主要成分.Al2O3属于( )
| A、酸 | B、盐 | C、氧化物 | D、单质 |
常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是( )
| A、过滤后的溶液中一定没有S2- |
| B、MnS难溶于水,可溶于MnCl2溶液中 |
| C、常温时,CuS、PbS、CdS比MnS更难溶 |
| D、加入MnS后生成CuS的离子方程式是Cu2++S2-=CuS↓ |
下列物质中除水分子外,无其他分子存在的是( )
| A、氨水 | B、氯水 |
| C、浓硫酸 | D、食盐水 |
某原子的最外电子层上只有1个电子,则它跟氯结合能形成的化学键( )
| A、一定是共价键 |
| B、一定是离子键 |
| C、可能是共价键,也可能是离子键 |
| D、以上说法均不正确 |
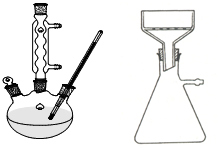 某实验室制取苯甲酸的过程如下:
某实验室制取苯甲酸的过程如下: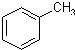 +2KMnO4
+2KMnO4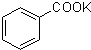 +MnO2+KOH+H2O
+MnO2+KOH+H2O