题目内容
某同学为检验溶液中是否含有常见的几种离子,进行了如图所示的实验操作.其中,检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是( )

| A、原溶液中一定含有SO42- |
| B、原溶液中不一定含有NH4+ |
| C、原溶液中一定含有Cl- |
| D、原溶液中含Fe2+、Fe3+至少有一种 |
考点:常见阴离子的检验,常见阳离子的检验
专题:
分析:在溶液中加入盐酸酸化的硝酸钡,其中的亚硫酸根离子、亚铁离子会被氧化为硫酸根离子、铁离子,加入的盐酸中含有氯离子,会和硝酸银反应生成氯化银白色沉淀,能使红色石蕊试纸变蓝的气体是氨气,三价铁离子能使硫氰酸钾变为红色.
解答:
解:A、原溶液中加入盐酸酸化的硝酸钡,如果其中含有亚硫酸根离子,则会被氧化为硫酸根离子,所以原溶液中不一定含有SO42-离子,故A错误;
B、产生能使红色石蕊试纸变蓝的气体是氨气,所以原来溶液中一定含有铵根离子,故B错误;
C、原溶液中加入盐酸酸化的硝酸钡,引进了氯离子,能和硝酸银反应生成氯化银沉淀的离子不一定是原溶液中含有的氯离子,可能是加进去的盐酸中的,故C错误;
D、原溶液中加入盐酸酸化的硝酸钡,如果其中含有亚铁离子,则亚铁离子会被氧化为铁离子,铁离子能使硫氰酸钾变为红色,所以原溶液中含有Fe2+、Fe3+中的至少有一种,故D正确,
故选D.
B、产生能使红色石蕊试纸变蓝的气体是氨气,所以原来溶液中一定含有铵根离子,故B错误;
C、原溶液中加入盐酸酸化的硝酸钡,引进了氯离子,能和硝酸银反应生成氯化银沉淀的离子不一定是原溶液中含有的氯离子,可能是加进去的盐酸中的,故C错误;
D、原溶液中加入盐酸酸化的硝酸钡,如果其中含有亚铁离子,则亚铁离子会被氧化为铁离子,铁离子能使硫氰酸钾变为红色,所以原溶液中含有Fe2+、Fe3+中的至少有一种,故D正确,
故选D.
点评:本题是一道关于离子反应和离子检验知识的题目,考查学生分析和解决问题的能力,难度中等.

练习册系列答案
相关题目
A、B、C为三种短周期元素.A、B同周期,A、C的最低价离子分别为A2-、C-离子,且半径A2->C-,B2+与C-具有相同的电子层结构.下列说法不正确的是( )
| A、原子序数 A>B>C |
| B、离子半径 A2->C->B2+ |
| C、原子半径 C>B>A |
| D、最外层电子数 C>A>B |
如图所示的电化学装置,下列叙述正确的是( )
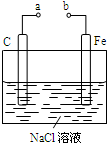

| A、a和b用导线连接,电子由碳经过导线流向铁 |
| B、a和b用导线连接,铁电极的电极反应为:Fe-3e-=Fe3+ |
| C、a、b分别连接直流电源正、负极,可以防止铁被腐蚀 |
| D、a、b分别连接直流电源负、正极,电压足够大时,Na+向铁电极移动 |
人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图.下列有关说法正确的是( )

| A、a为电源的负极 |
| B、电解结束后,阴极室溶液的pH与电解前相比将升高 |
| C、阳极室中发生的电极反应为2H++2e-=H2↑ |
| D、若两极共收集到气体13.44L(标准状况),则除去的尿素为7.2g(忽略气体的溶解) |
 已知蓄电池在充电时作电解池,放电时作原电池.如图是铅蓄电池的工作示意图,其反应原理为:PbO2+Pb+2H2SO4
已知蓄电池在充电时作电解池,放电时作原电池.如图是铅蓄电池的工作示意图,其反应原理为:PbO2+Pb+2H2SO4| 放电 |
| 充电 |
| A、b电极放电后转化为c电极 |
| B、电极a和d都发生还原反应 |
| C、b的电极反应式:Pb+SO42--2e→PbSO4 |
| D、放电后硫酸溶液的pH增大 |
下列有关物质的叙述不正确的是( )
| A、淀粉水解可以制得葡萄糖 |
| B、碘酒可使细菌、病毒的蛋白质变性而死亡 |
| C、氨基酸是两性化合物,能与酸或碱反应生成盐 |
| D、光导纤维遇盐酸和氢氧化钠溶液都不会被损坏 |
羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.下列有关说法正确的是( )
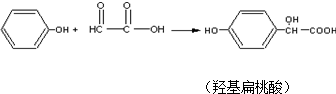

| A、苯酚和羟基扁桃酸互为同系物 |
| B、标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24 NA |
| C、乙醛酸只存在一种不同环境的氢原子 |
| D、羟基扁桃酸分子中至少有12个原子共平面. |
下列原理正确且离子方程式也正确的是( )
| A、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- |
| B、Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O |
| C、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| D、0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2-+2H2O |