题目内容
18. 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.(1)一定温度下,向1L 0.1mol•L-1CH3COOH溶液中加入0.1mol CH3COONa固体,溶液中
$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式c(CH3COO-)+c(OH-)=c(Na+)+c(H+).
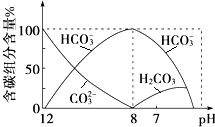
(2)常温下向20mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-不能(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有HCO3-、H2CO3,溶液中含量最多的三种微粒的物质的量浓度的大小关系为c(Na+)>c(Cl-)>c(HCO3-).
分析 (1)Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$只与温度有关;溶液中存在电荷守恒;
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①根据图2可知,pH=8时只有碳酸氢根离子,pH大于8时存在碳酸根离子和碳酸氢根离子离子,pH小于8时存在碳酸和碳酸氢根离子,在同一溶液中,H2CO3、HCO3-、CO32-不能共存;
②pH=7时,溶液中溶质为碳酸氢钠、氯化钠及碳酸,存在的离子主要为:H2CO3、HCO3-,溶液显示中性,c(H+)=c(OH-),根据电荷守恒判断溶液中各离子浓度大小关系.
解答 解:(1)一定温度下,向1L 0.1mol•L-1CH3COOH溶液中加入0.1mol CH3COONa固体,由于温度不变,而Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ 只与温度有关,所以$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$的比值不变;溶液中存在电荷守恒为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),
故答案为:不变;c(CH3COO-)+c(OH-)=c(Na+)+c(H+);
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①由反应及图象可知,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,
故答案为:不能;
②由图象可知,pH=7时,溶液中含碳元素的主要微粒为HCO3-、H2CO3,电荷守恒可知c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-),则c(Na+)>c(Cl-),因HCO3-水解,则溶液中含量最多的三种微粒的物质的量浓度的大小关系为:c(Na+)>c(Cl-)>c(HCO3-),
故答案为:HCO3-;H2CO3;c(Na+)>c(Cl-)>c(HCO3-).
点评 本题考查离子浓度大小比较,题目难度中等,涉及盐类的水解、弱电解质的电离及溶液中酸碱之间的反应,试题有利于综合考查学生分析问题、解决问题的能力,注意掌握盐的水解原理、电荷守恒的含义及应用方法.

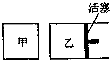 在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2SO3(g)并达到平衡.在反应过程中,
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2SO3(g)并达到平衡.在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为a%,乙容器中SO2的转化率为b%,则a与b的关系为( )
| A. | a>b | B. | a=b | C. | a<b | D. | 无法确定 |
| A. | X的两种氧化物中阴阳个数比均为1:2 | |
| B. | Y的氧化物熔点高,常用作耐高温材料 | |
| C. | Z的氧化物属于酸性氧化物,不能与任何酸反应 | |
| D. | R的同主族氢化物稳定性从上往下依次减弱 |
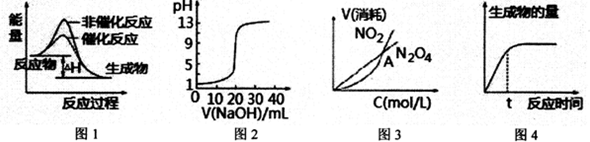
| A. | 图l表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1 000mol•L-1 CH3COOH溶液所得到的滴定曲线 | |
| C. | 图3表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. | 图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正>v逆 |
| A. | NaCl晶体、铜 | B. | 稀硫酸、二氧化硫 | C. | 液态的醋酸、液氨 | D. | 熔融的KNO3、硝酸 |
 ,则A的结构简式为(CH3)3CCH=CH2.
,则A的结构简式为(CH3)3CCH=CH2. A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题: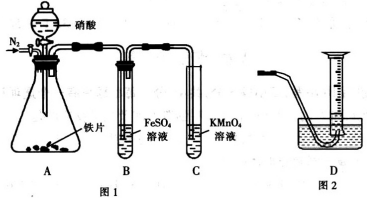 为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验.
为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验.