题目内容
8.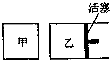 在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2SO3(g)并达到平衡.在反应过程中,
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2SO3(g)并达到平衡.在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为a%,乙容器中SO2的转化率为b%,则a与b的关系为( )
| A. | a>b | B. | a=b | C. | a<b | D. | 无法确定 |
分析 先假定甲、乙的体积都不变,达到平衡后再保持乙的压强不变,此反应是气体体积减小的反应,因此,待等体积达平衡后,欲保持乙的压强不变,就需要缩小体积.缩小体积则乙相对于甲的压强增大,平衡正向移动.
解答 解:先假定甲、乙的体积都不变,达到平衡后再保持乙的压强不变,此反应是气体体积减小的反应,因此,待等体积达平衡后,欲保持乙的压强不变,就需要缩小体积.缩小体积则乙相对于甲的压强增大,平衡正向移动.所以,乙容器中SO2的转化率为b%,则甲的SO2的转化率将小于乙的,即小于b%.
故选C.
点评 这一类问题的解决方法一般如此,先设为同等条件,平衡后再改变某一条件使之符合题设条件,分析变化.这样,问题就迎刃可解了.

练习册系列答案
相关题目
3.下列关于Na2CO3和NaHCO3性质的说法错误的是( )
| A. | 热稳定性:NaHCO3<Na2CO3 | |
| B. | 与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3 | |
| C. | 相同温度时,在水中的溶解性:NaHCO3<Na2CO3 | |
| D. | 等物质的量浓度溶液的碱性:NaHCO3<Na2CO3 |
3.反应2A(g)+B(g)?2C(g)△H<0.下列反应条件有利于生成C的是( )
| A. | 低温、低压 | B. | 低温、高压 | C. | 高温、高压 | D. | 高温、低压 |
13.将一定体积的SO3(g)充入恒容的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值增大的是( )
| A. | 平衡常数 | B. | SO3(g)的转化率 | C. | 总压强 | D. | 总体积 |
20.一定条件下,向一带活塞的密闭容器中充入3mol H2和1mol N 2,发生下列反应:3H2(g)+N2(g)?2NH3(g).达到平衡后改变下述条件,HN3气体平衡浓度不改变的是( )
| A. | 保持温度和容器内压强不变,充入1molNH3(g) | |
| B. | 保持温度和容器内压强不变,充入1molAr(g) | |
| C. | 保持温度和容器体积不变,充入1molN2(g) | |
| D. | 保持温度和容器体积不变,充入1molNH3(g) |
17.常温时,在(NH4)2SO4溶液中滴加Ba(OH)2溶液,下列有关选项正确的是( )
| A. | 滴加前:c(NH4+)+c(H+)=c(OH-)+c(SO42-) | |
| B. | 滴加前:c(NH4+)+c(NH3•H2O)=c(SO42-) | |
| C. | 滴加至完全沉淀:c(OH-)>c(NH4+)>c(H+) | |
| D. | 滴加至中性:c(SO42-)=2c(NH4+)>c(H+)=c(OH-) |
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.