题目内容
7.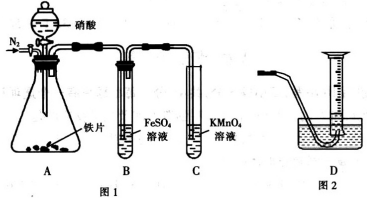 为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验.
为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验.查阅资料
i.NO+Fe(NO)SO4(棕色)
ii.KMnO4溶液可氧化吸收NO和NO2
iii.0.2mol•L-1 NaOH溶液可完全吸收NO、NO2混合气体中的NO2,而不吸收NO
实验Ⅰ用以下装置验证铁和过量12mol?L-1硝酸反应产生的气体中含有NO
(1)图1的A装置中加入硝酸前需加入N2一段时间的目的是排除装置内的空气,防止对NO的检验产生干扰.
(2)通N2一段时间后,加入12mol?L-1硝酸后看到A装置中产生红棕色气体,B装置中溶液变棕色.根据实验现象不能确定产生的气体中含有NO,理由是NO2在B装置中与水反应生成NO.请在图1装置的基础上提出改进措施在A和B装置间增加一个装有0.2mol•L-1NaOH溶液的洗气装置.
(3)用图1的A装置和图2装置可测量反应产生的NO体积,实验操作如下
A.连接装置,并检查气密性
B.往A装置中加入铁片后,再往分液漏斗加入12mol?L-1的硝酸
C.通N2一段时间后关闭
D.向水槽中加入0.2mol?L-1NaOH溶液
e.打开分液漏斗活塞,加入一定量12mol?L-1硝酸后,关闭活塞
f.将装满0.2mol?L-1NaOH溶液的量筒倒扣在水槽中
g.待反应装置恢复至室温时,读取数据
①操作的正确顺序是a→b→d→c→f→e→g
②读取数据时应注意上下移动量筒使量筒内溶液的液面与水槽的液面相平,视线与量筒内的凹液面相平.
实验Ⅱ对4mol?L-1硝酸与过量铁反应的产物进行探究
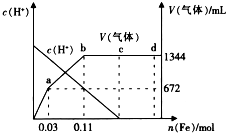
反应过程中溶液中c(H+)和产生气体的体积(标准状况下)随铁的消耗量变化关系如下图所示.
(4)据图推测HNO3在bc段的还原产物是NH4+或NH4NO3(填化学式);若在ab段只产生单一的气体,则该气体是N2O(填化学式).
分析 铁和硝酸反应,因硝酸有强氧化性,能氧化铁为+3价,如果硝酸过量,氧化产物只有+3价铁,如果铁过量,因Fe3+也能氧化铁,故有Fe生成,浓硝酸的还原产物为NO2,稀硝酸的还原产物为NO,NO还原性比较强,遇空气中的氧气能立即氧化为NO2红棕色气体,据此分析可作答;
(1)通N2可排除装置内的空气,避免NO被空气中的氧气氧化;
(2)NO2为红棕色气体,能溶解于水并与水反应生成NO,反应方程式为3NO2+H2O=2HNO3+NO;在图1装置的基础要增加一个除NO2气体的装置,通常可选用盛装NaOH溶液的洗气瓶装;
(3)①操作顺序应该是先检查装置气密性、装药品,通氮气排空气、向槽内加入少量NaOH溶液、将装满0.2mol?L-1NaOH溶液的量筒倒扣在水槽中、打开分液漏斗使反应进行并收集气体、最后冷却后读出气体的体积;
②正确读数时一定要量筒和水槽内液面相平,视线也要与量筒内的凹液面相平;
(4)bc段仍消耗HNO3,说明反应仍在进行,但无气体增加,可知HNO3的还原产物不是气体氮氧化物,而应该是溶性的铵盐,ab段消耗Fe的物质的量0.11mol-0.03mol=0.08mol,因溶液中仍有硝酸,氧化产物为Fe3+,故铁失去电子数为0.08mol×3=0.24mol,ab段生成气体的体积为672mL,物质的量为$\frac{0.672L}{22.4L/mol}$=0.03mol,根据电子守恒推测硝酸还原产物;
解答 解:(1)因NO遇空气易氧化,先通N2可除去空气,避免NO氧化,故答案为:排除装置内的空气,防止对NO的检验产生干扰;
(2)反应产生红棕色气体说明有NO2生成,因NO2能与水反应生成NO,故无法证明反应生成NO,可选择在装置1中添加盛装NaOH溶液的洗气瓶除去NO2,故答案为:NO2在B装置中与水反应生成NO;在A和B装置间增加一个装有0.2 mol•L-1 NaOH溶液的洗气装置;
(3)①依照先检查装置气密性、装药品、再进行实验的原则,正确的操作顺序为d c f e 或c d f e,故答案为:d c f e 或c d f e;
②为保证量筒内气体的压强也外界大气压强相等,可上下移动量筒使量筒内溶液的液面与水槽的液面相平,读数时要确保视线与量筒内的凹液面相平,故答案为:上下移动量筒使量筒内溶液的液面与水槽的液面相平,视线与量筒内的凹液面相平;
(4)反应进行过程中无气体生成,可知生成物为可溶性的铵盐,即还原产物为NH4+,ab段消耗Fe的物质的量是0.08mol,失去电子数为0.24mol,生成气体的物质的量为0.03mol,如果还原产物为NO,则硝酸得电子数为0.03mol×3=0.09mol≠0.24mol,此时电子不守恒,若为N2O,则硝酸得电子数为0.03mol×2×4=0.24mol,此时得失电子守恒,故可知硝酸的还原产物为N2O,故答案为:NH4+或NH4NO3;N2O.
点评 本题以铁与硝酸的反应为载体,探究硝酸的还原产物,涉及实验的基本操作及混合物的分离提纯,另外还考查了氧化还原反应的分析,特别是电子守恒定律规律的应用及计算,整体属基础性考查,难度不大,重在培养学生分析问题和解决问题的能力.

| A. | 滴加前:c(NH4+)+c(H+)=c(OH-)+c(SO42-) | |
| B. | 滴加前:c(NH4+)+c(NH3•H2O)=c(SO42-) | |
| C. | 滴加至完全沉淀:c(OH-)>c(NH4+)>c(H+) | |
| D. | 滴加至中性:c(SO42-)=2c(NH4+)>c(H+)=c(OH-) |
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 水电离出来的c(H+)=1.0×10-12mol/L的溶液中,Al3+不可能大量存在 | |
| C. | 0.1mol/L的氨水中滴加稀盐酸至过量,可能有:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 在25℃时,将pH=5的醋酸溶液与pH=9的KOH溶液等体积混合,则充分反应后的混合液:c(CH3COO-)>c(H+)>c(K+)>c(OH-) |
| A. | CO2、SO2都是酸性氧化物 | |
| B. | 盐类物质一定含有金属离子 | |
| C. | H2O、HCOOH、(NH4)2Fe(SO4)2中均含有氧元素,都是氧化物 | |
| D. | 凡能电离出H+的化合物均属酸 |
| A. | 硫酸 纯碱 硫酸钠 | B. | 氢溴酸 烧碱 绿矾 | ||
| C. | 碳酸 乙酸 醋酸钠 | D. | 磷酸 熟石灰 苛性钠 |
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存. 如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答:
如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答: