题目内容
3.(1)氢氧燃料电池的电极反应式随电解质溶液的不同而不同.电池的负极通的应是H2,如果电解质溶液为KOH,则负极电极反应式为2H2+4OH--4e-═4H2O.如果电解质溶液为稀H2SO4则正极电极反应式为O2+4H++4e-═2H2O.(2)甲烷燃料电池,KOH作电解质溶液,负极电极反应式为:CH4+10OH--8e-═CO32-+7H2O.
分析 (1)氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水,阳极上氧气得电子和水反应生成氢氧根离子;氢氧燃料酸性电池中,负极上氢气失电子生成氢离子,正极上氧气得电子和氢离子反应生成水,据此书写电极反应式;
(2)碱性条件下,甲烷在负极失电子生成碳酸根离子和水.
解答 解:(1)氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水,阳极上氧气得电子和水反应生成氢氧根离子,碱性条件下,负极反应式为H2-2e-+2OH-═2H2O;氢氧燃料酸性电池中,负极上氢气失电子生成氢离子,正极上氧气得电子和氢离子反应生成水,正极反应式为O2+4e-+4H+═2H2O,
故答案为:H2;H2-2e-+2OH-═2H2O;O2+4e-+4H+═2H2O;
(2)碱性条件下,甲烷在负极失电子生成碳酸根离子和水,则负极电极反应式为:CH4+10OH--8e-═CO32-+7H2O;
故答案为:CH4+10OH--8e-═CO32-+7H2O.
点评 本题考查了燃料电池,注意把握燃料电池中电极的判断和电极反应式的书写,电极反应式的书写要结合电解质溶液酸碱性,题目难度中等,侧重于考查学生的分析能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.将一定体积的SO3(g)充入恒容的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值增大的是( )
| A. | 平衡常数 | B. | SO3(g)的转化率 | C. | 总压强 | D. | 总体积 |
8.NH3经一系列反应可以得到HNO3,如图所示.
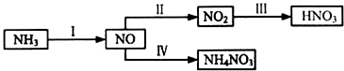
(1)已知反应N2(g)+3H2(g)?2NH3(g)△H,在恒压密闭容器中达到平衡状态.
①根据表中所列键能数据,可得△H=3a+c-6b kJ•mol-1.(用含a、b、c的式子表示)
②往上述平衡体系中充入氩气,此时v (N2)正减小(填“增大”、“减小”或“不变”)
(2)某温度下,密闭容器发生反应N2O4(g)?2NO2(g),
相互转化时的量变关系如图所示.请回答:
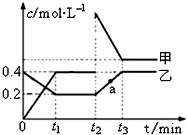
①代表乙的物质是N2O4(填“N2O4”或“NO2”)
②反应进行到t2时刻,改变的条件可能是增大NO2的浓度
③已知:N2(g)+O2(g)?2NO(g)△H=+180.5kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H=-283kJ•mol-1
治理汽车尾气过程中,将NO和CO转化成CO2和N2的反应的热化学方程式为2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-746.5 kJ•mol-1
(3)电解NO制备 NH4NO3的工作原理如图所示,
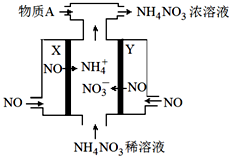
总反应为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3
①NH4NO3溶液中离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-)
②X极的电极反应为NO+6H++5e-=NH4++H2O
③为使电解过程中阳极产生的NO3-与阴极产生的NH4+全部转化为NH4NO3,需补充的物质A为NH3(填化学式)

(1)已知反应N2(g)+3H2(g)?2NH3(g)△H,在恒压密闭容器中达到平衡状态.
①根据表中所列键能数据,可得△H=3a+c-6b kJ•mol-1.(用含a、b、c的式子表示)
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | a | b | c |
(2)某温度下,密闭容器发生反应N2O4(g)?2NO2(g),
相互转化时的量变关系如图所示.请回答:

①代表乙的物质是N2O4(填“N2O4”或“NO2”)
②反应进行到t2时刻,改变的条件可能是增大NO2的浓度
③已知:N2(g)+O2(g)?2NO(g)△H=+180.5kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H=-283kJ•mol-1
治理汽车尾气过程中,将NO和CO转化成CO2和N2的反应的热化学方程式为2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-746.5 kJ•mol-1
(3)电解NO制备 NH4NO3的工作原理如图所示,

总反应为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3
①NH4NO3溶液中离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-)
②X极的电极反应为NO+6H++5e-=NH4++H2O
③为使电解过程中阳极产生的NO3-与阴极产生的NH4+全部转化为NH4NO3,需补充的物质A为NH3(填化学式)
13.下列化学方程式中,不能用离子方程式Ba2++SO42-═BaSO4↓表示的是( )
| A. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | B. | BaCl2+Na2SO4═BaSO4↓2NaCl | ||
| C. | BaCl2+H2SO4═BaSO4↓+2HCl | D. | BaCO3+H2SO4═BaSO4↓+H2O+CO2↑ |
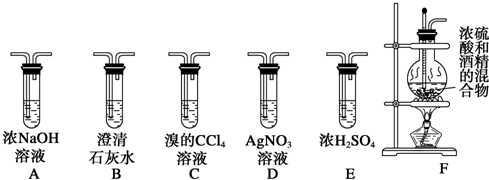
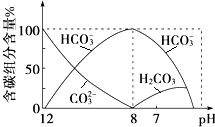 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.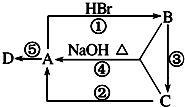 如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答:
如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答:


