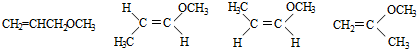题目内容
6.用石墨电极完成下列电解实验.| 实验一 | 实验二 | |
| 装置 | 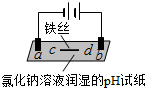 | 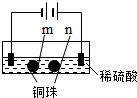 |
| 现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;… |
| A. | a、d处:2H2O+2e-═H2↑+2OH- | |
| B. | b处:2Cl--2e-═Cl2↑ | |
| C. | c处发生了反应:Fe-2e-═Fe2+ | |
| D. | 根据实验一的原理,实验二中m处能析出铜 |
分析 实验一a、d处试纸变蓝,说明生成OH-,为电解池的阴极,b处变红,局部褪色,为电解池的阳极,生成氯气,c处无明显变化,铁丝左侧为阳极,右侧为阴极,
实验二两个石墨电极附近有气泡产生,左侧生成氢气,右侧生成氧气,两个铜珠的左侧为阳极,右侧为阴极,n处有气泡产生,为阴极,以此解答该题.
解答 解:A.d处试纸变蓝,为阴极,生成OH-,电极方程式为2H2O+2e-═H2↑+2OH-,故A正确;
B.b处变红,局部褪色,是因为Cl2+H2O=HCl+HClO,HCl的酸性使溶液变红,HClO的漂白性使局部褪色,故B错误;
C.c处为阳极,发生了反应:Fe-2e-═Fe2+,故C正确;
D.实验一中ac形成电解池,db形成电解池,所以实验二中也相当于形成三个电解池,一个球两面为不同的两极,左边铜珠的左侧为阳极,发生的电极反应为Cu-2e-=Cu2+,右侧(即位置m处)为阴极,发生的电极反应为Cu2++2e-=Cu,同样右边铜珠的左侧为阳极,右侧(即位置n处)为阴极,因此m处能析出铜的说法正确,故D正确.
故选B.
点评 本题考查电解原理,侧重于学生的分析能力的考查,注意把握电极的判断以及电极反应,为解答该题的关键,题目易错点为D,注意铜珠的左右侧可看出阴、阳极,难度中等.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
3.K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+.用K2Cr2O7溶液进行下列实验:
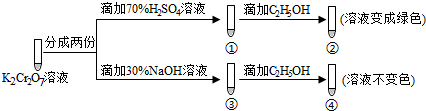
结合实验,下列说法不正确的是( )

结合实验,下列说法不正确的是( )
| A. | ①中溶液橙色加深,③中溶液变黄 | |
| B. | ②中Cr2O72-被C2H5OH还原 | |
| C. | 对比②和④可知K2Cr2O7酸性溶液氧化性强 | |
| D. | 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 |
1.如图为常温下向25mL0.1mol•L-1 MOH溶液中逐滴滴加0.2mol•L-1 HCl溶液过程中溶液pH的变化曲线,下列推断正确的是( )
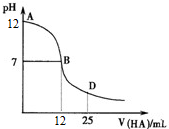

| A. | MOH在水中的电离方程式是MOH═M++OH- | |
| B. | 在B点表示酸碱恰好中和 | |
| C. | 随着盐酸的加入,溶液的导电能力逐渐增强(忽略体积变化) | |
| D. | 在D点时,存在c(OH-)>c(Na+)>c(Cl-)>c(M+) |
11.将铜币置于20mL 0.1mol/L的AgNO3溶液中,可观察到( )
| A. | 溶液变红 | B. | 铜币表面变色 | C. | 溶液颜色不变 | D. | 有大量气泡冒出 |
15.某有机物的结构简式如图所示,下列说法正确的是( )
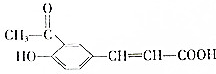

| A. | 1mol该有机物最多可与6mol H2发生加成反应 | |
| B. | 该有机物可发生水解反应、取代反应和氧化反应 | |
| C. | 加入碳酸氢钠溶液,产生气泡,说明含有羧基 | |
| D. | 加入溴水,溴水褪色,说明含有碳碳双键 |
2.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
| W | X | |
| Y | Z |
| A. | W单质的化学性质很活泼 | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z气态氢化物稳定性最弱的是Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
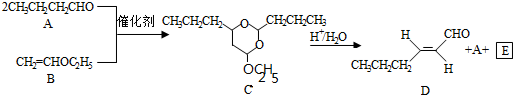
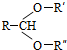 $\stackrel{H+/H_{2}O}{→}$RCHO+R′OH+R″OH
$\stackrel{H+/H_{2}O}{→}$RCHO+R′OH+R″OH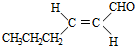 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$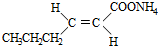 +2Ag↓+3NH3+H2O(或者
+2Ag↓+3NH3+H2O(或者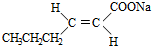 +Cu2O↓+3H2O).
+Cu2O↓+3H2O).