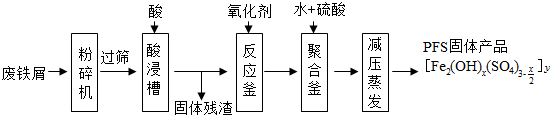
题目内容
3.K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+.用K2Cr2O7溶液进行下列实验: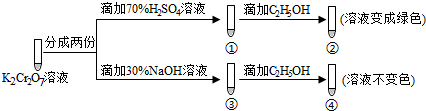
结合实验,下列说法不正确的是( )
| A. | ①中溶液橙色加深,③中溶液变黄 | |
| B. | ②中Cr2O72-被C2H5OH还原 | |
| C. | 对比②和④可知K2Cr2O7酸性溶液氧化性强 | |
| D. | 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 |
分析 K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,加入酸,氢离子浓度增大,平衡逆向移动,则溶液橙色加深,加入碱,平衡正向移动,溶液变黄,由实验②、④可知Cr2O72-具有较强的氧化性,可氧化乙醇,而CrO42-不能,以此解答该题.
解答 解:A.在平衡体系中加入酸,平衡逆向移动,重铬酸根离子浓度增大,橙色加深,加入碱,平衡正向移动,溶液变黄,故A正确;
B.②中重铬酸钾氧化乙醇,重铬酸钾被还原,故B正确;
C.②是酸性条件,④是碱性条件,酸性条件下氧化乙醇,而碱性条件不能,说明酸性条件下氧化性强,故C正确;
D.若向④溶液中加入70%的硫酸到过量,溶液为酸性,可以氧化乙醇,溶液变绿色,故D错误.
故选D.
点评 本题综合考查氧化还原反应以及化学平衡的移动问题,侧重于学生的分析能力的考查,注意把握题给信息,为解答该题的关键,易错点为D,注意Cr2O72-、CrO42-氧化性的比较,难度不大.

练习册系列答案
相关题目
13.化学与人类生产、生活、社会可持续发展密切相关.下列说法正确的是( )
| A. | 鼓励使用太阳能、风能等淸洁能源能减少PM2.5的污染 | |
| B. | 用含有橙色酸性K2Cr207的仪器检验酒驾,利用了乙醇的挥发性和氧化性 | |
| C. | 粮食酿酒的制造原理为淀粉水解变成葡萄糖,葡萄糖再水解得到酒精 | |
| D. | 与铜质水龙头连接处的钢质水管易发生析氢腐蚀 |
14.以下事实中可以用相似相溶原理说明的是( )
| A. | HCl易溶于水 | B. | I2可溶于水 | C. | Cl2可溶于水 | D. | CO2可溶于水 |
11.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解:再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,震荡后仍有固体存在.
该白色粉末可能为( )
①取少量样品加入足量水仍有部分固体未溶解:再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,震荡后仍有固体存在.
该白色粉末可能为( )
| A. | NaHCO3、Al(OH)3 | B. | AgCl、NaHCO3 | C. | Na2SO3、BaCO3 | D. | Na2CO3、CuSO4 |
18. 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>X>Y | ||
| C. | Y的氢化物常温常压下为液态 | D. | X的最高价氧化物的水化物为强酸 |
8.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
| A. | 简单离子半径:W<X<Z | |
| B. | W与X形成的化合物溶于水后溶液呈碱性 | |
| C. | 气态氢化物的热稳定性:W<Y | |
| D. | 最高价氧化物的水化物的酸性:Y>Z |
17.我国科技创新成果斐然,下列成果中获得诺贝尔奖的是( )
| A. | 徐光宪建立稀土串级萃取理论 | B. | 屠呦呦发现抗疟新药青蒿素 | ||
| C. | 闵恩泽研发重油裂解催化剂 | D. | 侯德榜联合制碱法 |
6.用石墨电极完成下列电解实验.
下列对实验现象的解释或推测不合理的是( )
| 实验一 | 实验二 | |
| 装置 | 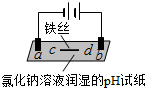 | 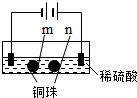 |
| 现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;… |
| A. | a、d处:2H2O+2e-═H2↑+2OH- | |
| B. | b处:2Cl--2e-═Cl2↑ | |
| C. | c处发生了反应:Fe-2e-═Fe2+ | |
| D. | 根据实验一的原理,实验二中m处能析出铜 |