题目内容
1.如图为常温下向25mL0.1mol•L-1 MOH溶液中逐滴滴加0.2mol•L-1 HCl溶液过程中溶液pH的变化曲线,下列推断正确的是( )
| A. | MOH在水中的电离方程式是MOH═M++OH- | |
| B. | 在B点表示酸碱恰好中和 | |
| C. | 随着盐酸的加入,溶液的导电能力逐渐增强(忽略体积变化) | |
| D. | 在D点时,存在c(OH-)>c(Na+)>c(Cl-)>c(M+) |
分析 常温下0.1mol•L-1 MOH溶液中pH=12,则c(OH-)=0.01mol/L,所以MOH在溶液中部分电离,即MOH为弱碱,
A.MOH在溶液中部分电离,用可逆号表示;
B.酸碱恰好反应生成强酸弱碱盐,在溶液中水解显酸性;
C.MOH为弱电解质,加盐酸产生MCl为强电解质,溶液中离子浓度增大;
D.25mL0.1mol•L-1 MOH溶液中逐滴滴加0.2mol•L-1 HCl溶液,当HCl的体积为25mL时,溶液中溶质为等物质的量的MCl和HCl,溶液显酸性.
解答 解:常温下0.1mol•L-1 MOH溶液中pH=12,则c(OH-)=0.01mol/L,所以MOH在溶液中部分电离,即MOH为弱碱,
A.MOH在溶液中部分电离,用可逆号表示,则电离方程式为:MOH?M++OH-,故A错误;
B.酸碱恰好反应生成强酸弱碱盐MCl,MCl在溶液中水解显酸性,B点表示的溶液的pH=7,溶液显中性,所以B点不是酸碱恰好中和的点,故B错误;
C.MOH为弱电解质,加盐酸产生MCl为强电解质,溶液中离子浓度增大,所以溶液的导电性增强,故C正确;
D.25mL0.1mol•L-1 MOH溶液中逐滴滴加0.2mol•L-1 HCl溶液,当HCl的体积为25mL时,溶液中溶质为等物质的量的MCl和HCl,溶液显酸性,则溶液中离子浓度关系为:c(Cl-)>c(H+)>c(M+)>c(OH-),故D错误.
故选C.
点评 本题考查了酸碱混合时的定性判断、离子浓度大小比较,注意根据酸溶液的pH和酸的浓度确定酸的强弱,为易错点,题目难度中等,明确图象曲线对应溶质组成为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18. 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>X>Y | ||
| C. | Y的氢化物常温常压下为液态 | D. | X的最高价氧化物的水化物为强酸 |
4.煤燃烧排放的烟含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
(1)NaClO2的化学名称为亚氯酸钠.
(2)在鼓泡反应器中通入含SO2、NOx的烟气,反应温度323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表.
①写出NaClO2溶液脱硝过程中主要反应的离子方程式3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O.增加压强,NO的转化率提高(填“提高”、“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小(填“增大”、“不变”或“减小”).
③由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”)原因是除了SO2和NO在烟气中初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压Pe如图所示.
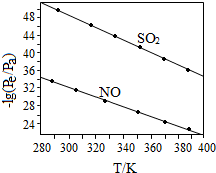
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均减小(填“增大”、“不变”或“减小”).
②反应ClO2-+2SO32-═2SO42-+Cl-的平衡常数K表达式为$\frac{c(C{l}^{-}){c}^{2}(S{{O}_{4}}^{2-})}{c(Cl{{O}_{2}}^{-}){c}^{2}(S{{O}_{3}}^{2-})}$.
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高.
②已知下列反应:
SO2(g)+2OH-(aq)═SO32-(aq)+H2O(l)△H1
ClO-(aq)+SO32-(aq)═SO42-(aq)+Cl-(aq)△H2
CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)═CaSO4(s)+H2O(l)+Cl-(aq)的△H=△H1+△H2-△H3.
(1)NaClO2的化学名称为亚氯酸钠.
(2)在鼓泡反应器中通入含SO2、NOx的烟气,反应温度323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表.
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小(填“增大”、“不变”或“减小”).
③由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”)原因是除了SO2和NO在烟气中初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压Pe如图所示.

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均减小(填“增大”、“不变”或“减小”).
②反应ClO2-+2SO32-═2SO42-+Cl-的平衡常数K表达式为$\frac{c(C{l}^{-}){c}^{2}(S{{O}_{4}}^{2-})}{c(Cl{{O}_{2}}^{-}){c}^{2}(S{{O}_{3}}^{2-})}$.
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高.
②已知下列反应:
SO2(g)+2OH-(aq)═SO32-(aq)+H2O(l)△H1
ClO-(aq)+SO32-(aq)═SO42-(aq)+Cl-(aq)△H2
CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)═CaSO4(s)+H2O(l)+Cl-(aq)的△H=△H1+△H2-△H3.
1.仅能在水溶液中导电的电解质是( )
| A. | KOH | B. | KNO3 | C. | NH4HCO3 | D. | 酒精 |
8.若烃(CxH2x-6)符合下列两个条件,则烃(CxH2x-6)的一氯代物共有(不考虑立体异构)( )
①1个CxH2x-6分子中碳与氢原子之间形成8个共价键
②烃(CxH2x-6)中含一个苯环.
①1个CxH2x-6分子中碳与氢原子之间形成8个共价键
②烃(CxH2x-6)中含一个苯环.
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
6.用石墨电极完成下列电解实验.
下列对实验现象的解释或推测不合理的是( )
| 实验一 | 实验二 | |
| 装置 |  |  |
| 现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;… |
| A. | a、d处:2H2O+2e-═H2↑+2OH- | |
| B. | b处:2Cl--2e-═Cl2↑ | |
| C. | c处发生了反应:Fe-2e-═Fe2+ | |
| D. | 根据实验一的原理,实验二中m处能析出铜 |
13.下列对氨基酸和蛋白质的描述正确的是( )
| A. | 蛋白质水解的最终产物是氨基酸 | |
| B. | 氨基酸和蛋白质遇重金属离子均会变性 | |
| C. | α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽 | |
| D. | 氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向负极移动 |
17.下列有关物质性质的应用不正确的是( )
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮藏罐贮运浓硫酸 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | 次氯酸具有强氧化性,因此氯气可用于自来水的杀菌消毒 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
