题目内容
9.现代生活需要提升我们的科学素养,以下说法科学的是( )| A. | 某护肤品广告宣称产品不含任何化学成分 | |
| B. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| C. | 日用铝制品表面不用刷漆防腐蚀 | |
| D. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的 |
分析 A.产品中物质均为化学成分;
B.漂白粉易与空气中的水、二氧化碳反应生成次氯酸,次氯酸不稳定,易分解;
C.铝与氧气反应生成致密氧化膜;
D.汽车尾气中氮氧化物的产生是由于空气中的氮气与氧气在放电的时候生成的;
解答 解;A.所以物质都含有化学成分,不含化学成分的物质不存在,故A错误;
B.漂白粉易与空气中的水、二氧化碳反应生成次氯酸,次氯酸不稳定易分解,所以漂白粉变质不是被氧气氧化,故B错误;
C.铝与氧气反应生成致密氧化膜阻止铝与氧气继续反应,所以日用铝制品表面不用刷漆防腐蚀,故C正确;
D.汽车尾气中氮氧化物的产生是由于空气中的氮气与氧气在放电的时候生成的,汽油中主要是烃,故D错误;
故选:C.
点评 本题考查了物质的结构与性质,熟悉相关物质的性质是解题关键,注意对化学知识的积累.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
8.用32gCu与300mL12mol/L的浓硝酸反应,当铜全部溶解后,共收集到标准状况下的气体11.2L(不考虑NO2转化为N2O4),反应消耗的硝酸的物质的量是( )
| A. | 1.5mol | B. | 1.8mol | C. | 3.3mol | D. | 3.6mol |
17.常温下,一定量的乙酸溶液与氢氧化钠溶液发生中和反应,下列说法正确的( )
| A. | c(CH3COO-)=c(Na+)时,参加反应的乙酸与氢氧化钠的物质的量之比为1:1 | |
| B. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,不一定是醋酸过量 | |
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 | |
| D. | c(CH3COO-)=c(Na+)时,该溶液一定呈中性 |
4.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法不正确的是( )


| A. | 简单离子半径的大小顺序g>h>e>f | |
| B. | 与x 形成化合物的沸点:d>z>y | |
| C. | zh3中各原子均满足8电子结构 | |
| D. | x、y、z、d四种元素各自最高价和最低价代数和分别为0、0、2、4 |
14.短周期元素A、B、C的原子序数依次增大,其原子的最外层电子数中和为10,A与C在周期表中位于同一族,B原子最外层电子数等于A原子次外层电子数,下列有关叙述不正确的是( )
| A. | A与C可形成共价化合物 | |
| B. | A的简单氢化物的稳定性大于C的简单氢化物的稳定性 | |
| C. | 原子半径:A<B<C | |
| D. | B的氧化物的熔点比A的最高价氧化物熔点高 |
1.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数为3.75NA | |
| D. | 235g核素$\stackrel{239}{92}$U发生裂变反应:$\stackrel{239}{92}$ U+$\stackrel{1}{0}$n$\stackrel{裂变}{→}$$\stackrel{90}{38}$Sr+$\stackrel{136}{54}$U+10$\stackrel{1}{0}$n,净产生的中子($\stackrel{1}{0}$n)数为10 NA |
18.分子式C4H8O为并能与金属Na反应放出气体的单官能团的有机物(不含立体异构)有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 ,
, +2Na→
+2Na→ +H2↑
+H2↑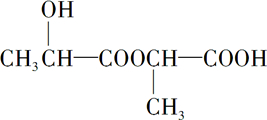 .
.