题目内容
8.用32gCu与300mL12mol/L的浓硝酸反应,当铜全部溶解后,共收集到标准状况下的气体11.2L(不考虑NO2转化为N2O4),反应消耗的硝酸的物质的量是( )| A. | 1.5mol | B. | 1.8mol | C. | 3.3mol | D. | 3.6mol |
分析 反应生成的气体为NO2,或者NO2与NO混合气体,反应消耗的硝酸生成Cu(NO3)2、氮的氧化物,根据氮原子守恒计算消耗硝酸的物质的量.
解答 解:反应生成的气体为NO2,或者NO2与NO混合气体,反应消耗的硝酸生成Cu(NO3)2、氮的氧化物,
则n(NO2)+n(NO)=$\frac{11.2L}{22.4L/mol}$=0.5mol,即被还原的硝酸的物质的量为0.5mol,
n(Cu)=$\frac{32g}{64g/mol}$=0.5mol,则生成n[Cu(NO3)2]=0.5mol,可知表现酸性的硝酸的物质的量为0.5mol×2=1mol,
则参加反应的硝酸的物质的量为:1mol+0.5mol=1.5mol.
故选:A.
点评 本题考查硝酸性质、化学方程式有关计算,注意根据原子守恒进行解答,避免气体组成的判断,侧重分析计算能力的考查,题目难度中等.

练习册系列答案
相关题目
18.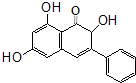 高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
 高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )| A. | 高良姜素的分子式为C15H15O5 | |
| B. | 高良姜素分子中含有3个羟基、8个双键 | |
| C. | 高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应 | |
| D. | 1mol高良姜素与足量的钠反应生成33.6LH2 |
19.取少量蔗糖溶液于试管中,加入3~5滴稀硫酸,水浴加热5分钟后,加入少量新制的Cu(OH)2,加热3~5分钟,结果没有出现砖红色物质,而是看到了黑色物质.下列分析错误的是( )
| A. | 滴入的稀硫酸太少 | |
| B. | 不可能产生砖红色沉淀,因为水浴加热后未用碱液调节溶液的PH至碱性 | |
| C. | 蔗糖水解的最终产物不仅有葡萄糖,而且有果糖 | |
| D. | 产生的黑色物质可能是Cu(OH)2受热分解的产物CuO |
3.下列说法中,正确的是( )
| A. | 糖类、蛋白质、橡胶、油脂都是天然高分子化合物 | |
| B. | 加热会使蛋白质变性,因此食生鸡蛋所获营养价值高 | |
| C. | 通过灼烧时产生的气味可以鉴别蚕丝和棉纱 | |
| D. | 检验淀粉在稀硫酸催化下水解程度的方法是:取适量水解液于试管中,加入少量碘水,若出现蓝色说明没有水解 |
13.下列做法科学的是( )
| A. | 将废电池深埋 | B. | 大量使用化肥 | ||
| C. | 开发太阳能、风能和氢能 | D. | 大量开发利用可燃冰 |
20.常温下,下列各组离子在溶液中一定能大量共存的是( )
| A. | Na+、Al3+、OH- | B. | Ba2+、NO3-、SO42- | C. | K+、Na+、NO3- | D. | K+、NH4+、OH- |
9.现代生活需要提升我们的科学素养,以下说法科学的是( )
| A. | 某护肤品广告宣称产品不含任何化学成分 | |
| B. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| C. | 日用铝制品表面不用刷漆防腐蚀 | |
| D. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的 |