题目内容
14.短周期元素A、B、C的原子序数依次增大,其原子的最外层电子数中和为10,A与C在周期表中位于同一族,B原子最外层电子数等于A原子次外层电子数,下列有关叙述不正确的是( )| A. | A与C可形成共价化合物 | |
| B. | A的简单氢化物的稳定性大于C的简单氢化物的稳定性 | |
| C. | 原子半径:A<B<C | |
| D. | B的氧化物的熔点比A的最高价氧化物熔点高 |
分析 B原子最外层电子数等于A原子次外层电子数,则B的最外层电子数为2,根据它们的原子的最外层电子数之和为10、A与C在周期表中同主族可知,A、C的最外层电子数为4,故A为C元素、C为Si元素;A、B、C原子序数依次增大,则B为Mg元素,据此结合元素周期律知识解答.
解答 解:B原子最外层电子数等于A原子次外层电子数,则B的最外层电子数为2,根据它们的原子的最外层电子数之和为10、A与C在周期表中同主族,可知A、C的最外层电子数为4,故A为C元素、C为Si元素,A、B、C原子序数依次递增,则B为Mg元素,
A.A与C形成的化合物为SiC,为共价化合物,故A正确;
B.同主族自上而下非金属性减弱,非金属性越强,氢化物的越强,非金属性C>Si,A的简单氢化物的稳定性大于C的氢化物,故B正确;
C.A为C元素、B为Mg元素、C为Si元素,同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,所以原子半径为Mg>Si>C,即A<C<B,故C错误;
D.A的氧化物二氧化碳为分子晶体,B的氧化物氧化镁为离子晶体,则B的氧化物的熔点比A的最高价氧化物熔点高,故D正确;
故选C.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,根据题干信息正确推断元素为解答关键,注意掌握元素周期表结构、元素周期律内容,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
13.下列做法科学的是( )
| A. | 将废电池深埋 | B. | 大量使用化肥 | ||
| C. | 开发太阳能、风能和氢能 | D. | 大量开发利用可燃冰 |
5.19世纪中叶,俄国化学家门捷列夫对化学这一学科的巨大贡献是( )
| A. | 提出了原子学说 | B. | 发现了元素周期律 | ||
| C. | 提出了分子学说 | D. | 制定了科学完整的元素周期表 |
2.在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-92.3KJ/mol
0~4min时,容器气体压强为101KPa.反应过程中,SO2、O2、SO3的物质的量(mol)的变化如表:
回答下列问题:
①3~4min和7~9min时,反应处于平衡状态.
②第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强.
0~4min时,容器气体压强为101KPa.反应过程中,SO2、O2、SO3的物质的量(mol)的变化如表:
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
①3~4min和7~9min时,反应处于平衡状态.
②第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强.
9.现代生活需要提升我们的科学素养,以下说法科学的是( )
| A. | 某护肤品广告宣称产品不含任何化学成分 | |
| B. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| C. | 日用铝制品表面不用刷漆防腐蚀 | |
| D. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的 |
6.化学与生产、生活、环境、社会密切相关,下列有关说法不正确的是( )
| A. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它属于新型无机非金属材料 | |
| B. | 工业生产玻璃、水泥、陶瓷,均需要用到石灰石为原料 | |
| C. | 用二氧化碳合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 固体煤经过处理变为气体燃料后,可以减少SO2和烟尘的排放,且燃烧效率提高,有利于“节能减排” |
3.下列关于有机化合物的结构、性质的叙述正确的是( )
| A. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体 | |
| D. | 乙醇、乙酸均能与NaOH反应,因为分子中均含有官能团“-OH” |
4.下列装置应用于实验室进行相关实验,能达到实验目的是( )
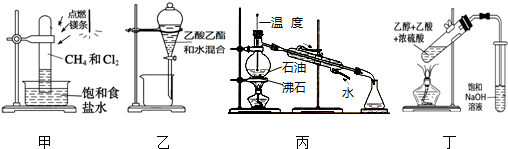

| A. | 用装置甲在强光照条件下制取一氯甲烷 | |
| B. | 用装置乙分离乙酸乙酯和水 | |
| C. | 用装置丙蒸馏石油并收集60~150℃馏分 | |
| D. | 用装置丁制取并收集乙酸乙酯 |
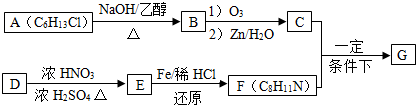
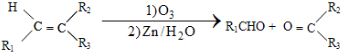
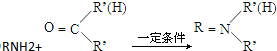
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$  +H2O;
+H2O; ;
; ,(写出其中的一种的结构简式).
,(写出其中的一种的结构简式).
 .
.