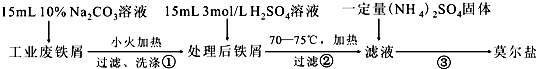
题目内容
8.下列有关化学用语的说法不正确的是( )| A. | -OH与 都表示羟基 都表示羟基 | B. | 如图是食盐晶体的晶胞 | ||
| C. | CH4分子的球棍模型: | D. | 次氯酸分子的电子式: |
分析 A.羟基中的半键表示氧原子中的孤电子;
B.氯化钠晶胞: ;
;
C.甲烷为正四面体结构;
D.次氯酸的中心原子是氧原子.
解答 解:A.-OH为羟基结构简式,羟基的电子式为 ,故A正确;
,故A正确;
B.氯化钠晶胞: ,故B错误;
,故B错误;
C.甲烷的球棍模型应该用小球和短棍表示,甲烷为正四面体结构,其正确的球棍模型为: ,故C错误;
,故C错误;
D.次氯酸的中心原子是氧原子,次氯酸的电子式为 ,故D正确;
,故D正确;
故选:BC.
点评 本题考查了化学用语的使用,涉及电子式、球棍模型、结构简式的使用,熟悉常用相关化学用语使用注意即可解答,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
18.向一定量的Fe、Fe2O3和CuO混合物投入100mL浓度2.2mol/L的硫酸溶液中.充分反应后生成896mL标准状况下的气体.得不溶物1.28g,过滤后.溶液中金属阳离子只有Fe2+.向滤液中加入2mol/L的NaOH溶液.加至40mL时开始出现沉淀.则滤液中FeSO4的物质的量浓度为(设滤液体积为100mL)( )
| A. | 2 mol/L | B. | 1.8 mol/L | C. | 1.9 mol/L | D. | 无法计算 |
19. 请根据下表,回答下列问题:(数据均在25℃时测定)
请根据下表,回答下列问题:(数据均在25℃时测定)
(1)物质的量浓度为0.1mol•L-1的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,由水电离产生的H+由大到小的顺序是a>b>d>c(填编号).
(2)常温下0.1mol•L-1的HClO溶液加水稀释过程,下列表达式的数据不变的是D;
A.c (H+) B.$\frac{c({H}^{+})}{c(HClO)}$C.$\frac{c(O{H}^{-})}{c({H}^{+})}$D.$\frac{c(Cl{O}^{-})}{c(HClO)•c(O{H}^{-})}$
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示,则Ka(HX)> (选填>、=、<,下同) Ka(CH3COOH);若将浓度为c1的NaOH溶液与0.1mol/L的HX等体积混合,
所得溶液的pH=7,则c1<0.1mol/L,溶液中离子浓度的大小关系为:c(Na+)=c(X-)>c(OH-)=c(H+);若将“0.1mol/L的HX”改为“pH=1的HX”,所得溶液的pH仍为7,则c1>0.1mol/L.
(4)室温下,如果将0.1mol CH3COONa和0.05mol HCl溶于水,形成混合溶液(体积不变)
①CH3COOH和CH3COO-两种粒子的物质的量之和等于0.1mol.
②CH3COO-和OH-两种粒子的物质的量之和比H+多0.05mol.
(5)某硫酸铜溶液里c(Cu2+)=0.02mol•L-1,如要生成Cu(OH)2,应调整溶液pH,使之大于5;要使0.2mol•L-1硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液,使溶液pH为6.
 请根据下表,回答下列问题:(数据均在25℃时测定)
请根据下表,回答下列问题:(数据均在25℃时测定)| 化学式 | CH3COOH | H2CO3 | HClO | Cu(OH)2 |
| 相关常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 | Ksp=2×10-20 |
(2)常温下0.1mol•L-1的HClO溶液加水稀释过程,下列表达式的数据不变的是D;
A.c (H+) B.$\frac{c({H}^{+})}{c(HClO)}$C.$\frac{c(O{H}^{-})}{c({H}^{+})}$D.$\frac{c(Cl{O}^{-})}{c(HClO)•c(O{H}^{-})}$
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示,则Ka(HX)> (选填>、=、<,下同) Ka(CH3COOH);若将浓度为c1的NaOH溶液与0.1mol/L的HX等体积混合,
所得溶液的pH=7,则c1<0.1mol/L,溶液中离子浓度的大小关系为:c(Na+)=c(X-)>c(OH-)=c(H+);若将“0.1mol/L的HX”改为“pH=1的HX”,所得溶液的pH仍为7,则c1>0.1mol/L.
(4)室温下,如果将0.1mol CH3COONa和0.05mol HCl溶于水,形成混合溶液(体积不变)
①CH3COOH和CH3COO-两种粒子的物质的量之和等于0.1mol.
②CH3COO-和OH-两种粒子的物质的量之和比H+多0.05mol.
(5)某硫酸铜溶液里c(Cu2+)=0.02mol•L-1,如要生成Cu(OH)2,应调整溶液pH,使之大于5;要使0.2mol•L-1硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液,使溶液pH为6.
16.在下列有机物分子中,核磁共振氢谱中给出的信号峰数目相同的一组是( )


| A. | ①⑤ | B. | ②④ | C. | ④⑤ | D. | ⑤⑥ |
13.能正确表示下列反应的离子方程式是( )
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
18.苹果酸结构简式为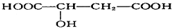 ,苹果酸可能发生的反应是( )
,苹果酸可能发生的反应是( )
①与NaOH溶液反应
②与石蕊试液作用变红
③与金属钠反应放出气体
④一定条件下能发生消去反应
⑤一定条件下能发生氧化反应.
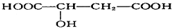 ,苹果酸可能发生的反应是( )
,苹果酸可能发生的反应是( )①与NaOH溶液反应
②与石蕊试液作用变红
③与金属钠反应放出气体
④一定条件下能发生消去反应
⑤一定条件下能发生氧化反应.
| A. | ①②③ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
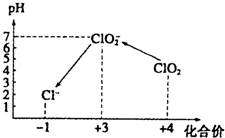 ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.