题目内容
13.下列化学键中,键的极性最强的是( )| A. | H-F | B. | H-O | C. | H-N | D. | H-C |
分析 共价键极性强弱与两原子的电负性相关,也可以理解为得电子能力,电负性相差越大,极性越强,碳氮氧氟同周期,原子半径依次减小,F的半径最小,电负性最强,故H-F键的极性最强.
解答 解:共价键极性强弱与两原子的电负性相关,也可以理解为得电子能力,电负性相差越大,极性越强,碳氮氧氟同周期,原子半径依次减小,但相差不大,氢原子半径更小,F的半径最小,电负性最强,故H-F极性最强,
故选A.
点评 本题考查了共价键极性的强弱,明确共价键极性强弱与两原子的电负性的关系是解题关键,题目难度不大.

练习册系列答案
相关题目
8.氢氧化镁是一种用途广泛、极具开发前景的环保材料,广泛应用在阻燃、废水中和、烟气脱硫等方面.镁硅酸盐矿石(主要成分Mg3Si2O5(OH)4,含氧化铝、氧化铁、氧化亚铁等杂质)可用于生产氢氧化镁,简要工艺流程如图1:

已知:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
(1)对矿石焙烧的目的是改变矿石结构,提高酸浸率.
(2)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)向溶液Ⅰ中加入的X可以是MgO或Mg(OH)2、MgCO3,
作用是调节溶液pH.
(4)加入氨水时,Mg2+转化率随温度t的变化如图2所示:
①溶液Ⅱ中发生反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
②t1前Mg2+转化率增大的原因是镁离子与氨水反应是吸热反应,升高温度,平衡右移,Mg2+转化率增大;
t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.

已知:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(2)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)向溶液Ⅰ中加入的X可以是MgO或Mg(OH)2、MgCO3,
作用是调节溶液pH.
(4)加入氨水时,Mg2+转化率随温度t的变化如图2所示:
①溶液Ⅱ中发生反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
②t1前Mg2+转化率增大的原因是镁离子与氨水反应是吸热反应,升高温度,平衡右移,Mg2+转化率增大;
t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
18.苹果酸结构简式为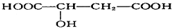 ,苹果酸可能发生的反应是( )
,苹果酸可能发生的反应是( )
①与NaOH溶液反应
②与石蕊试液作用变红
③与金属钠反应放出气体
④一定条件下能发生消去反应
⑤一定条件下能发生氧化反应.
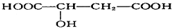 ,苹果酸可能发生的反应是( )
,苹果酸可能发生的反应是( )①与NaOH溶液反应
②与石蕊试液作用变红
③与金属钠反应放出气体
④一定条件下能发生消去反应
⑤一定条件下能发生氧化反应.
| A. | ①②③ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
2.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得,下列有关说法正确的是( )
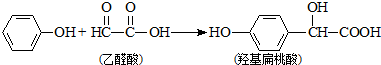
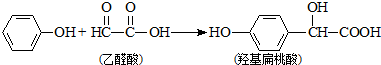
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与2molBr2反应发生加成反应 | |
| C. | 羟基扁桃酸分子中至少有12个原子共平面 | |
| D. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 |
9.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温下,1 mol Cl2与足量NaOH溶液完全反应,转移的电子数2NA | |
| B. | 常温常压下,11.2 L CO2中含有的分子数是0.5NA | |
| C. | 标准状况下,22.4 L水所含原子数为3NA | |
| D. | 常温常压下,48 g O3和O2的混合气体中氧原子数为3NA |
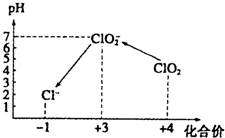 ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
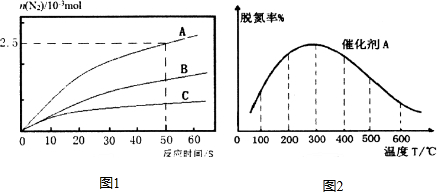 研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.
研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.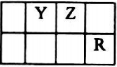 己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答:
己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答: .
.