题目内容
16.下列物质的性质与氢键无关的是( )| A. | 甲烷的熔沸点比硅烷的低 | |
| B. | NH3易液化 | |
| C. | NH3分子比PH3分子稳定 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
分析 氢键是分子间作用力的一种,F、O、N的电负性较强,对应的氢化物分子之间能形成氢键,氢键的存在,多数物质的物理性质有显著的影响,如熔点、沸点,溶解度等,存在氢键的物质,水溶性显著增强,分子间作用力增强,熔沸点升高或降低,据此分析解答.
解答 解:A.甲烷与硅烷分子中均不含有氢键,甲烷的熔沸点比硅烷的低,是因为甲烷的相对分子质量小于硅烷,故A选;
B.氨气分子间存在氢键,键的存在使得分子间作用力增强,使得氨气易液化,故B不选;
C.NH3分子、PH3分子稳定性与H-N键、H-P的键能有关,所以NH3分子比PH3分子稳定,与氢键无关,故C选;
D.在相同条件下,H2O的沸点比H2S高,是由于H2O分子间存在氢键,作用力比分子间作用力强,沸点较高,故D不选;
故选AC.
点评 本题考查氢键的性质,要注意氢键是一种分子间的相互作用,比化学键弱,比分子间作用力强,把握氢键与分子间作用力、共价键的区别,题目难度不大.

练习册系列答案
相关题目
6.下列物质中,既含有离子键,又含有共价键的是( )
| A. | H2O2 | B. | NaOH | C. | CaO | D. | SO2 |
7.下列实验能达到目的是( )
| 实验目的 | 实验步骤 | |
| A | 检验久置的Na2SO3粉末是否变质 | 取样配成溶液,加入盐酸酸化,再加BaCl2溶液,观察是否生成沉淀 |
| B | 检验碘盐中是否含有碘元素 | 取样配成溶液,加入淀粉溶液,观察溶液是否变蓝 |
| C | 检验碳单质与浓硫酸反应的产物 | 将反应生成的气体通过无水硫酸铜粉末、澄清石灰水、品红溶液 |
| D | 探究铁与水在高温下发生反应 | 将水蒸气通过灼热的铁粉看粉末是否变红 |
| A. | A | B. | B | C. | C | D. | D |
11. 2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质
2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质
实验中可能用到的数据:

实验步骤:①按体积比3:1配制浓硫酸与浓硝酸混合物40mL;
②在三颈瓶中加入20.0mL甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出2-硝基甲苯和4-硝基甲苯并称重,其总总质量为13.7g.
(1)在烧杯中配制该实验所需混酸的方法是分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌.
(2)步骤④的关键是控制温度,其措施有水浴加热、充分搅拌和控制滴加混酸的速度
分离产物的方案如下:

回答下列问题:
操作ii中会用到下列仪器中的ac(填序号).
a.温度计b.蒸发皿c.锥形瓶d.分液漏斗
该实验中2-硝基甲苯和4-硝基甲苯的总产率为53.2%.
(4)实验中的无机混合物可以回收再利用,回收前需要测定各成分的浓度,取10.00mL无机混合物,加水稀释至100.00mL待用,取稀释液10.00mL,用0.1000mol•L-1NaOH溶液滴定至溶液呈中性,消化NaOH溶液VmL,另取稀释液10.00mL,加入过量BaCl2溶液,充分反应后过滤并将滤渣洗涤、干燥后称重,质量为Wg.
①取10.00mL稀释液的过程中,酸式滴定管的初始液面为0.20mL,左手控制活塞向锥形瓶中加稀释液,此时眼睛应该平视10.20mL的刻度线.
②设计简单实验证明滤渣已经洗涤干净:取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净
③原无机混合物中HNO3的浓度为0.1V-$\frac{2000w}{233}$mol•L-1(用含V和W的代数式表示)
 2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质
2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质实验中可能用到的数据:

| 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 2-硝基甲苯 | 137 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
| 4-硝基甲苯 | 137 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
②在三颈瓶中加入20.0mL甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出2-硝基甲苯和4-硝基甲苯并称重,其总总质量为13.7g.
(1)在烧杯中配制该实验所需混酸的方法是分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌.
(2)步骤④的关键是控制温度,其措施有水浴加热、充分搅拌和控制滴加混酸的速度
分离产物的方案如下:

回答下列问题:
操作ii中会用到下列仪器中的ac(填序号).
a.温度计b.蒸发皿c.锥形瓶d.分液漏斗
该实验中2-硝基甲苯和4-硝基甲苯的总产率为53.2%.
(4)实验中的无机混合物可以回收再利用,回收前需要测定各成分的浓度,取10.00mL无机混合物,加水稀释至100.00mL待用,取稀释液10.00mL,用0.1000mol•L-1NaOH溶液滴定至溶液呈中性,消化NaOH溶液VmL,另取稀释液10.00mL,加入过量BaCl2溶液,充分反应后过滤并将滤渣洗涤、干燥后称重,质量为Wg.
①取10.00mL稀释液的过程中,酸式滴定管的初始液面为0.20mL,左手控制活塞向锥形瓶中加稀释液,此时眼睛应该平视10.20mL的刻度线.
②设计简单实验证明滤渣已经洗涤干净:取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净
③原无机混合物中HNO3的浓度为0.1V-$\frac{2000w}{233}$mol•L-1(用含V和W的代数式表示)
8.氢氧化镁是一种用途广泛、极具开发前景的环保材料,广泛应用在阻燃、废水中和、烟气脱硫等方面.镁硅酸盐矿石(主要成分Mg3Si2O5(OH)4,含氧化铝、氧化铁、氧化亚铁等杂质)可用于生产氢氧化镁,简要工艺流程如图1:

已知:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
(1)对矿石焙烧的目的是改变矿石结构,提高酸浸率.
(2)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)向溶液Ⅰ中加入的X可以是MgO或Mg(OH)2、MgCO3,
作用是调节溶液pH.
(4)加入氨水时,Mg2+转化率随温度t的变化如图2所示:
①溶液Ⅱ中发生反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
②t1前Mg2+转化率增大的原因是镁离子与氨水反应是吸热反应,升高温度,平衡右移,Mg2+转化率增大;
t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.

已知:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(2)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)向溶液Ⅰ中加入的X可以是MgO或Mg(OH)2、MgCO3,
作用是调节溶液pH.
(4)加入氨水时,Mg2+转化率随温度t的变化如图2所示:
①溶液Ⅱ中发生反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
②t1前Mg2+转化率增大的原因是镁离子与氨水反应是吸热反应,升高温度,平衡右移,Mg2+转化率增大;
t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
6.下列哪种物质可以鉴别乙醇和乙醛( )
| A. | 新制氢氧化铜 | B. | 碳酸钠溶液 | C. | 高锰酸钾溶液 | D. | FeCl3溶液 |

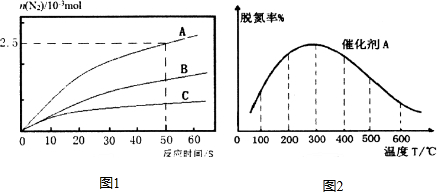 研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.
研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.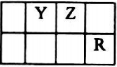 己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答:
己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答: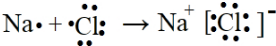 .
.