题目内容
9.下列图示与对应的叙述相符的是( )| A. |  表示某吸热反应分别在有、无催化剂的情况况下反应过程中的能量变化 | |
| B. |  表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH溶液体积的关系,则三种离子的物质的量之比比为(Mg2+):(Al3+):n(NH4+)=2:3:2 | |
| C. | 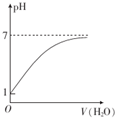 表示常温下0.10 mol•L-1的CH3COOH溶液加水稀释时溶液的pH变化 | |
| D. |  表示向10.00 mL 0.050 mol•L-1盐酸中逐滴加人0.025 mol•L-1的氨水时溶液的pH变化,其中 V1>20.00 |
分析 A.反应物的总能量大于生成物的总能量;催化剂降低反应的活化能;
B.氢氧化钠的体积在0-25mL时,Mg2+、Al3+与NaOH反应生成沉淀;在25-35mL,铵根离子与氢氧化钠反应生成一水合氨;35-40mL时,氢氧化铝与氢氧化钠反应,根据反应物之间的关系计算;
C.醋酸是弱酸,部分电离,醋酸的浓度大于氢离子浓度;
D.氨水与盐酸反应生成氯化铵溶液显酸性,若溶液显中性,则氨水要过量.
解答 解:A.吸热反应,反应物的总能量小于生成物的总能量,而图中反应物的总能量大于生成物的总能量,是放热反应,催化剂降低反应的活化能,故A错误;
B.氢氧化钠的体积在0-25mL时,Mg2+、Al3+与NaOH反应生成沉淀,Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓;在25-35mL,铵根离子与氢氧化钠反应生成一水合氨,NH4++OH-=NH3•H2O;35-40mL时,氢氧化铝与氢氧化钠反应,Al(OH)3+OH-=AlO2-+2H2O,NH4+消耗的NaOH的体积是Al(OH)3消耗的NaOH体积的2倍,则NH4+的浓度是Al3+浓度的2倍,故B错误;
C.醋酸是弱酸,部分电离,醋酸的浓度大于氢离子浓度,所以常温下0.10 mol•L-1的CH3COOH溶液中氢离子浓度小于0.1mol/L,所以pH大于1,故C错误;
D.向10.00 mL 0.050 mol•L-1盐酸中逐滴加人0.025 mol•L-1的氨水时,当氨水与盐酸恰好反应生成氯化铵溶液显酸性,若溶液显中性,则氨水要过量,所以V1>20.00,故D正确.
故选D.
点评 本题考查了化学反应的能量变化图、弱电解质的电离、离子反应及图象的分析计算,题目难度中等,把握弱电解质的电离特点、溶液中发生的反应及与图象的对应关系为解答的关键,侧重分析与推断能力的考查.

 请根据下表,回答下列问题:(数据均在25℃时测定)
请根据下表,回答下列问题:(数据均在25℃时测定)| 化学式 | CH3COOH | H2CO3 | HClO | Cu(OH)2 |
| 相关常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 | Ksp=2×10-20 |
(2)常温下0.1mol•L-1的HClO溶液加水稀释过程,下列表达式的数据不变的是D;
A.c (H+) B.$\frac{c({H}^{+})}{c(HClO)}$C.$\frac{c(O{H}^{-})}{c({H}^{+})}$D.$\frac{c(Cl{O}^{-})}{c(HClO)•c(O{H}^{-})}$
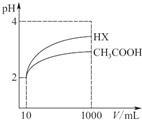
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示,则Ka(HX)> (选填>、=、<,下同) Ka(CH3COOH);若将浓度为c1的NaOH溶液与0.1mol/L的HX等体积混合,
所得溶液的pH=7,则c1<0.1mol/L,溶液中离子浓度的大小关系为:c(Na+)=c(X-)>c(OH-)=c(H+);若将“0.1mol/L的HX”改为“pH=1的HX”,所得溶液的pH仍为7,则c1>0.1mol/L.
(4)室温下,如果将0.1mol CH3COONa和0.05mol HCl溶于水,形成混合溶液(体积不变)
①CH3COOH和CH3COO-两种粒子的物质的量之和等于0.1mol.
②CH3COO-和OH-两种粒子的物质的量之和比H+多0.05mol.
(5)某硫酸铜溶液里c(Cu2+)=0.02mol•L-1,如要生成Cu(OH)2,应调整溶液pH,使之大于5;要使0.2mol•L-1硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液,使溶液pH为6.
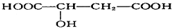 ,苹果酸可能发生的反应是( )
,苹果酸可能发生的反应是( )①与NaOH溶液反应
②与石蕊试液作用变红
③与金属钠反应放出气体
④一定条件下能发生消去反应
⑤一定条件下能发生氧化反应.
| A. | ①②③ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
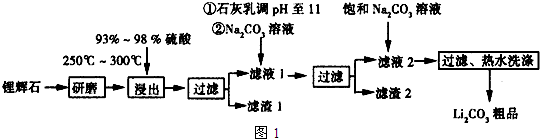
已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O
②某些物质的溶解度(S)如表所示.
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
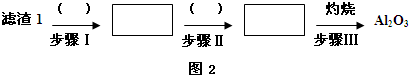
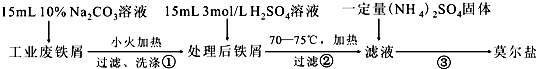
请写出Al2O3和Na2CO3固体在高温下反应的化学方程式Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2.
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)Ca(OH)2?Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀.
(3)最后一个步骤中,用“热水洗涤”的原因是减少Li2CO3的损失.
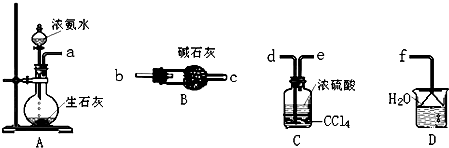
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$Li2CO3+NH3+2H2O.


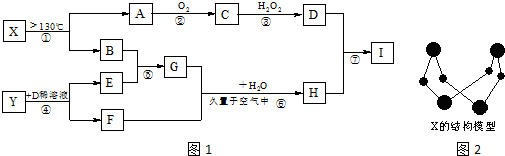
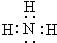 .
.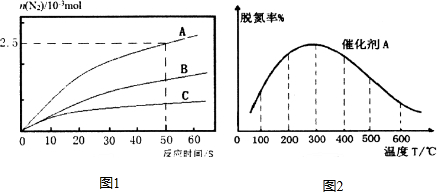 研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.
研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.