题目内容
3.常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,溶液呈碱性.(1)请比较此混合溶液中各离子的大小关系、电荷守恒表达式、与碳元素和钠元素有关的物料守恒表达式、与碳元素和氮元素有关的物料守恒表达式.
(2)若混合溶液中析出部分NaHCO3晶体,过滤,所得滤液pH<7,请比较此滤液中各离子的大小关系、电荷守恒表达式、与碳元素和钠元素有关的物料守恒表达式.
分析 常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,溶液呈碱性,说明NH4+水解程度小于HCO3-水解程度,
(1)二者混合没有碳酸氢钠析出时,溶液呈碱性,溶液中存在c(OH-)>c(H+),也说明NH4+水解程度小于HCO3-水解程度,HCO3-能电离但程度更小,Na+、Cl-不水解;
溶液中含有C元素的微粒有HCO3-、CO32-、H2CO3,含有N元素的微粒有NH4+、NH3.H2O,根据电荷守恒和物料守恒判断;
(2)若混合溶液中析出部分NaHCO3晶体,溶液中溶质为NH4HCO3、NH4Cl、NaCl,过滤,所得滤液pH<7,则存在c(OH-)<c(H+),钠离子、氯离子不水解,溶液中含有C元素的微粒有HCO3-、CO32-、H2CO3,结合物料守恒、电荷守恒判断.
解答 解:常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,溶液呈碱性,说明NH4+水解程度小于HCO3-水解程度,
(1)二者混合时没有碳酸氢钠析出时,因为溶液呈碱性,溶液中存在c(OH-)>c(H+),也说明NH4+水解程度小于HCO3-水解程度,HCO3-能电离但程度更小,Na+、Cl-不水解,溶液中离子浓度大小顺序是c(Na+)=c(Cl-)>c(NH4+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
溶液中存在的电荷守恒为c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(HCO3-)+c(Cl-)+2c(CO32-),
溶液中含有C元素的微粒有HCO3-、CO32-、H2CO3,
碳元素和钠元素有关的物料守恒为c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),
含有N元素的微粒有NH4+、NH3.H2O,
碳元素和氮元素有关的物料守恒为c(NH3.H2O)+c(NH4+)=c(HCO3-)+c(H2CO3)+c(CO32-),
故答案为:c(Na+)=c(Cl-)>c(NH4+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(HCO3-)+c(Cl-)+2c(CO32-);
c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-);
c(NH3.H2O)+c(NH4+)=c(HCO3-)+c(H2CO3)+c(CO32-);
(2)若混合溶液中析出部分NaHCO3晶体,溶液中溶质为NH4HCO3、NH4Cl、NaCl,过滤,所得滤液pH<7,则存在c(OH-)<c(H+),Na+、Cl-不水解,
溶液中存在的离子浓度大小顺序是c(Cl-)>c(NH4+)>c(Na+)>c(HCO3-)>c(H+)>c(CO32-)>c(OH-);
溶液中存在的电荷守恒为c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(HCO3-)+c(Cl-)+2c(CO32-);
溶液中含有C元素的微粒有HCO3-、CO32-、H2CO3,因为有碳酸氢钠析出,所以存在的C、Na元素之间的原子守恒为c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-);
故答案为:c(Cl-)>c(NH4+)>c(Na+)>c(HCO3-)>c(H+)>c(CO32-)>c(OH-);
c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(HCO3-)+c(Cl-)+2c(CO32-);
c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-).
点评 本题考查离子浓度大小比较、溶液中存在的守恒,明确溶液中溶质及其性质、溶液酸碱性是解本题关键,注意离子水解程度相对大小,难点是判断离子浓度大小,注意(2)题析出部分碳酸氢钠,导致溶液中溶质发生变化,为易错点.

| A. | 同温同压下,VLCO和H2的混合气体,完全燃烧消耗O2的体积为$\frac{V}{2}$L | |
| B. | 0.3mol氯化钠溶解于水,配成1L溶液,则氯化钠的物质的量的浓度为0.3mol/L | |
| C. | 4.2g氮气和4.8g某单质RX所含原子个数相同,且分子个数之比为1:1,则R的相对原子质量为16 | |
| D. | 在10%的NaOH溶液中,平均每9个水分子溶有1个OHˉ |
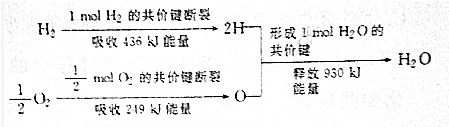
| A. | 氢气燃烧生成水蒸气时吸收热量 | |
| B. | 生成1molH2O吸收热量245kJ | |
| C. | 2molH和1molO所具有的能量大于1molH2和$\frac{1}{2}$molO2所具有的总能量 | |
| D. | 氢气和氧气的总能量大于水的能量 |
| A. | 室温下,向1L 0.10mol•L-1 CH3COOH溶液中通人HCl至溶液pH=7时溶液中氯离子与醋酸根离子的微粒数目之和为0.2NA | |
| B. | 25℃时,1L pH=12的NaOH溶液中,由水电离的H+数目为0.01NA | |
| C. | 氢氧燃料电池负极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | H2SO4(浓)+H2S=SO2↑+S↓+2H2O反应中,生成64gSO2时,转移的电子数目为6NA. |
| A. | 40% | B. | 66.7% | C. | 75% | D. | 92.3% |
| A. | 日常生中无水乙醇常用于杀菌消毒 | |
| B. | 目前加碘盐中主要添加的是KI | |
| C. | 绿色食品是不含任何化学物质的食品 | |
| D. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 |
| A. | 200 mL 2 mol/L MgCl2溶液 | B. | 400 mL 2.5 mol/L NaCl溶液 | ||
| C. | 250 mL 1 mol/L AlCl3溶液 | D. | 300 mL 5 mol/L KClO3溶液 |