题目内容
11.下列溶液中Cl-的物质的量浓度最大的是( )| A. | 200 mL 2 mol/L MgCl2溶液 | B. | 400 mL 2.5 mol/L NaCl溶液 | ||
| C. | 250 mL 1 mol/L AlCl3溶液 | D. | 300 mL 5 mol/L KClO3溶液 |
分析 氯离子的物质的量浓度与溶液体积无关,与溶质组成、溶质的物质的量浓度有关,注意D的溶液中不存在氯离子,据此对各选项进行计算.
解答 解:A.200 mL 2 mol/L MgCl2溶液中氯离子的浓度为:2mol/L×2=4mol/L;
B.400 mL 2.5 mol/L NaCl溶液中氯离子浓度为2.5mol/L;
C.250 mL 1 mol/L AlCl3溶液中氯离子的物质的量浓度为:1mol/L×3=3mol/L;
D.KClO3溶液中存在氯酸根离子和钾离子,不存在氯离子;
根据分析可知,Cl-的物质的量浓度最大的是A,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意离子的浓度与溶液体积大小无关,为易错点,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
19.下列关于化学反应速率的叙述正确的是( )
| A. | 在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值 | |
| B. | 化学反应速率为0.8 mol•L-1•s-1是指1秒钟时某物质的浓度为0.8 mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 化学反应的速率可以是g•(L•s)-1,也可以是kg•(L•s)-1,甚至可以用t•(L•s)-1表示 |
6.下列说法中正确的是( )
| A. | 氧化还原反应的实质是相互交换成分 | |
| B. | 在氧化还原反应中,化合价变化的一定是不同元素 | |
| C. | 在氧化还原反应中,氧化剂与还原剂一定是不同物质 | |
| D. | 某元素由游离态转化为化合态,这种元素不一定被氧化了 |
16.在冷的浓硝酸中,下列金属最难溶解的是( )
| A. | 银 | B. | 镁 | C. | 铝 | D. | 铜 |
3.在密闭容器中发生可逆反应4NH3+5O2?4NO+6H2O(g),以下是不同情况下的反应速率,其中最快的是( )
| A. | v(O2)=0.001mol/(L•S) | B. | v(NH3)=0.002 mol/(L•S) | ||
| C. | v(H2O)=0.003 mol/(L•h) | D. | v(NO)=0.008 mol/(L•S) |
1.下列关于化学用语的表述正确的是( )
| A. | 质量数为14的碳原子的表达式:${\;}_{8}^{14}$C | |
| B. | 乙醇的结构简式:C2H5OH | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 甲烷分子的球棍模型: |
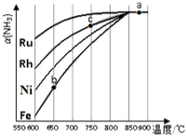 氨气在生产、生活和科研中应用十分广泛.
氨气在生产、生活和科研中应用十分广泛.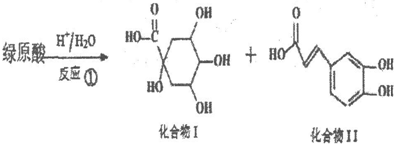
 .
.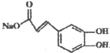 ),则试剂X是NaHCO3溶液.
),则试剂X是NaHCO3溶液.