题目内容
12.磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得.工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在2.1~7.2之间(已知磷酸的各级电离常数为K1=7.1×10-3、K2=6.3×10-8、K3=4.2×10-13,lg7.1≈0.9、lg6.3≈0.8、lg4.2≈0.6).Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,则溶液显酸性,其原因是3Ca2++2HPO42-=Ca3(PO4 )2↓+2H+(用离子方程式表示).分析 H3PO4?H++H2PO4-K1=7.1×10-3;H2PO4-?H++HPO42-K2=6.3×10-8;HPO42-?H++HPO43-K3=4.2×10-13;上一级电离产生的H+对下一级电离有抑制作用;为获得尽可能纯的NaH2PO4,需H2PO4-浓度最大,根据K1、K2、以及pH=-lgc(H+)计算;若向Na2HPO4溶液中加入足量的CaCl2溶液,HPO42-离子和Ca2+离子反应生成沉淀,促进HPO42-的电离,溶液显示酸性.
解答 解:为获得尽可能获得NaH2PO4,需配制磷酸、磷酸二氢钠的缓冲溶液,当溶液全部为磷酸溶液时,磷酸以第一步电离为主,所以H3PO4?H++H2PO4-K1=7.1×10-3;PH=-lgc(H+)=3-lg7.1≈2.1,
当溶液全部为NaH2PO4溶液时,H2PO4-?H++HPO42-K2=6.3×10-8,所以pH=-lgc(H+)=8-lg6.3≈7.2,
所以pH应控制介于2.1~7.2之间;HPO42-离子既能发生电离又能发生水解,电离反应式为HPO42-?PO43-+H+,水解反应式为HPO42-+H2O?H2PO4-+OH-,溶液呈碱性,说明水解程度大于电离程度;由于HPO42-离子和Ca2+离子反应生成沉淀:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+,促进HPO42-的电离,溶液则显酸性;
故答案为:2.1~7.2;3Ca2++2HPO42-=Ca3(PO4 )2↓+2H+.
点评 本题考查了弱电解质的电离、pH的计算,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握多元弱酸电离平衡的特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层电子数是次外层的3倍,Z原子最外层只有1个电子,W的最低负价为-3.下列叙述正确的是( )
| A. | X与W的最高正价之和为11 | |
| B. | Y的氢化物的稳定性比W的强 | |
| C. | 原子半径由大到小的顺序为W、Z、Y、X | |
| D. | Y分别与X、Z形成的化合物中化学键类型相同 |
20.如图所示实验能鉴别的一组物质是( )


| A. | 区分淀粉溶液和鸡蛋清溶液 | B. | 鉴别乙酸和乙醇 | ||
| C. | 鉴别自来水与豆浆 | D. | 鉴别乙酸乙酯与饱和Na0H溶液 |
7.油脂既是重要食物,又是重要化工原料,油脂的以下性质和用途与其含有的不饱和碳碳双键有关的是( )
| A. | 油脂在体内完全氧化时,提供的能量比糖类和蛋白质约高一倍 | |
| B. | 利用油脂在碱性条件下水解,可以生产甘油和肥皂 | |
| C. | 植物油通过氢化,即与氢气发生加成反应,可以制造植物奶油(人造奶油) | |
| D. | 天然油脂没有固定的熔沸点 |
17.银锌电池广泛用做各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2$?_{放电}^{充电}$Ag2O+Zn+H2O,在此电池放电时,正极上发生反应的物质是( )
| A. | Ag | B. | Zn(OH)2 | C. | Ag2O | D. | Zn |
6.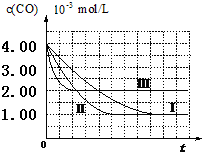 (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
【图象分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.5×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
 (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】
①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 6.50×10-3 | 4.00×10-3 | 120 | |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.5×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
3.两种短周期的元素X和Y,可组成化合物XY2,则X、Y的原子序数不可能是( )
| A. | 1和8 | B. | 6和8 | C. | 16和8 | D. | 12和17 |
4.下列过程中,共价键被破坏的是( )
| A. | HCl气体溶于水 | B. | 溴蒸气被木炭吸附 | ||
| C. | 酒精溶于水 | D. | 碘升华 |