题目内容
4.下列过程中,共价键被破坏的是( )| A. | HCl气体溶于水 | B. | 溴蒸气被木炭吸附 | ||
| C. | 酒精溶于水 | D. | 碘升华 |
分析 一般非金属元素之间形成共价键,由共价键形成的物质在溶于水、化学变化中共价键被破坏,以此来解答.
解答 解:A.HCl气体溶于水,发生电离,共价键被破坏,故A正确;
B.溴蒸气被木炭吸附,吸附的过程是物理变化过程,故B错误;
C.乙醇溶于水后,乙醇在水中以分子形式存在,所以没有化学键的破坏,故C错误;
D.碘升华克服的是分子间作用力,共价键没有破坏,故D错误.
故选A.
点评 本题考查化学键知识,题目难度不大,注意化学变化和物理变化的判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列变化的实质相似的是
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
②浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
③二氧化硫能使品红溶液、溴水褪色
④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸用铁的容器存放、加热条件下浓硫酸能与木炭反应( )
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
②浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
③二氧化硫能使品红溶液、溴水褪色
④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸用铁的容器存放、加热条件下浓硫酸能与木炭反应( )
| A. | 只有②③④ | B. | 只有⑤ | C. | 只有③④ | D. | 全部 |
12.下列反应的离子方程式正确的是( )
| A. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3 H2O═Fe(OH)3↓+3 H+ | |
| B. | 用小苏打治疗胃酸过多:HCO3ˉ+H+═CO2↑+H2O | |
| C. | 实验室用浓盐酸与MnO2反应制氯气:2Cl-+MnO2+2H+=Mn2++2H2O+Cl2↑ | |
| D. | 用FeCl3溶液腐蚀电路板:Fe3++Cu═Fe2++Cu2+ |
19.榄香烯是一种新型的抗癌药,它的结构简式如图,有关说法正确的是( )
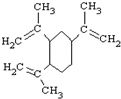

| A. | 榄香烯的分子式为C15H20 | |
| B. | 榄香烯属于芳香烃 | |
| C. | 榄香烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 | |
| D. | 1mol榄香烯最多能和3molH2反应 |
13.X、Y、M、N四种相邻主族短周期元素的相对位置如下表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性.
注意:用化学式回答下列问题(不要以字母代替)
(1)元素Y在周期表中的位置是第三周期第ⅢA族,其单质可采用电解熔融Al2O3的方法制备.
(2)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,将过量的N形成的最常见氢化物通入到Y的氯化物溶液中,产生的现象是产生白色沉淀.
(3)气体分子(MN)2的电子式为 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
| M | N | ||
| X | Y |
(1)元素Y在周期表中的位置是第三周期第ⅢA族,其单质可采用电解熔融Al2O3的方法制备.
(2)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,将过量的N形成的最常见氢化物通入到Y的氯化物溶液中,产生的现象是产生白色沉淀.
(3)气体分子(MN)2的电子式为
 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
14.在下列实验中,实验操作与现象一致的是( )
| 选项 | 实验操作 | 实验现象 |
| A | 将钠加入到硫酸铜溶液中 | 有气泡冒出,有红色固体析出 |
| B | 将足量过氧化氢加入到硫酸亚铁溶液中 | 无明显变化 |
| C | 将过氧化钠投入氯化亚铁溶液中 | 最终生成红褐色沉淀 |
| D | 将氢氧化钠溶液逐滴滴入氯化亚铁溶液中 | 立即产生红褐色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
 现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、U形管、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.
现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、U形管、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.