题目内容
5.在标准状况下,如果2.8L氢气含有a个氢原子,则阿伏加德罗常数可表示为( )| A. | amol-1 | B. | 2amol-1 | C. | 4amol-1 | D. | 8a mol-1 |
分析 根据n=$\frac{V}{Vm}$计算标准状况下2.8L氢气的物质的量,每个氢气分子含有2个氢原子,根据N=nNA计算阿伏伽德罗常数.
解答 解:标准状况下,2.8L氢气的物质的量为$\frac{2.8L}{22.4L/mol}$=$\frac{1}{8}$mol,
由每个氢气分子含有2个氢原子可知,
$\frac{1}{8}$mol×2×NA=n,
解得:NA=4nmol-1,
故选C.
点评 本题考查物质的量及阿伏伽德罗常数的计算,为高频考点,把握体积、物质的量、微粒数目的关系及相关计算公式为解答本题的关键,题目难度不大.

练习册系列答案
相关题目
13.下列过程没有发生化学反应的是( )
| A. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| B. | 用热碱水清除炊具上残留的油污 | |
| C. | 用活性炭去除冰箱中的异味 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
20.在P+CuSO4+H2O-Cu3P+H3PO4+H2SO4 (未配平)反应中,下列说法正确的是( )
| A. | CuSO4只做还原剂 | |
| B. | 10mol CuSO4可氧化P的物质的量为2mol | |
| C. | Cu3P既是氧化产物,又是还原产物 | |
| D. | 生成1mol Cu3P时,被氧化的P的物质的量为2.2mol |
10.在可逆反应中,平衡常数与反应进行的限度关系正确的是( )
| A. | K越大,反应程度越大 | B. | K越大,反应程度越小 | ||
| C. | K的大小与反应程度无关 | D. | 升高温度,K增大 |
17.下列叙述正确的是( )
| A. | 氯化钠溶液在电流作用下电离出钠离子与氯离子 | |
| B. | 硫酸钡难溶于水但硫酸钡属于电解质 | |
| C. | 溶于水后能电离出氢离子的化合物都是酸 | |
| D. | 水难电离,纯水几乎不导电,所以水一定不是电解质 |

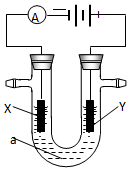 ( 1 )工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽.写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:
( 1 )工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽.写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式: