题目内容
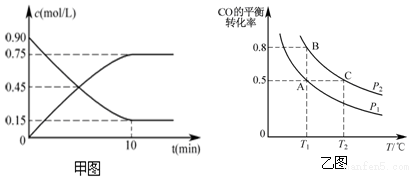
10.在可逆反应中,平衡常数与反应进行的限度关系正确的是( )| A. | K越大,反应程度越大 | B. | K越大,反应程度越小 | ||
| C. | K的大小与反应程度无关 | D. | 升高温度,K增大 |
分析 平衡常数是衡量反应进行程度的物理量,平衡常数越大,说明反应进行的程度越大,平衡常数越小,反应进行的程度越小,反应物的转化率越小;化学平衡常数只受温度影响.
解答 解:K越大,说明反应的程度越大,温度变化,平衡常数的变化取决于平衡移动的方向,如升高温度,平衡正向移动,则K增大,如逆向移动,则K减小.
故选A.
点评 本题考查化学平衡常数的意义、影响化学平衡常数的因素等,为高频考点,侧重于学生的分析能力的考查,题目比较基础,注意基础知识的理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下图所示的实验操作正确的是( )
| A. |  取用药品 | B. |  给试管加热 | ||
| C. |  滴加溶液 | D. |  称量氢氧化钠固体 |
5.在标准状况下,如果2.8L氢气含有a个氢原子,则阿伏加德罗常数可表示为( )
| A. | amol-1 | B. | 2amol-1 | C. | 4amol-1 | D. | 8a mol-1 |
15.在PH=1的溶液中,下列各组离子能大量共存的是( )
| A. | Al3+、Fe2+、Ba2+、NO3- | B. | Na+、K+、HCO3-、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | NH4+、Fe3+、SO42-、Cl- |
2.若NA表示阿伏加德罗常数,下列说法中,正确的是( )
| A. | 1mol镁原子中含有的电子数为2NA | |
| B. | 在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
20.已知几种物质的酸性强弱顺序为HCl>H2CO3> >HCO3-,则下列化学方程式错误的是( )
>HCO3-,则下列化学方程式错误的是( )
 >HCO3-,则下列化学方程式错误的是( )
>HCO3-,则下列化学方程式错误的是( )| A. | 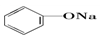 +HCl→ +HCl→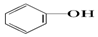 +NaCl +NaCl | B. | 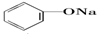 +H2O+CO2→ +H2O+CO2→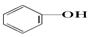 +NaHCO3 +NaHCO3 | ||
| C. | 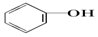 +Na2CO3→ +Na2CO3→ +NaHCO3 +NaHCO3 | D. |  +NaHCO3→ +NaHCO3→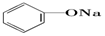 +H2CO3 +H2CO3 |