题目内容
16.红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO+Cr2O3(s)+8Na2CO3(s)+7O2?8Na2CrO4(s)+2Fe2O3(s)+8CO2△H<0
(1)请写出上述反应的化学平衡常数表达式:K=$\frac{{c}^{8}(C{O}_{2})}{{c}^{7}({O}_{2})}$.
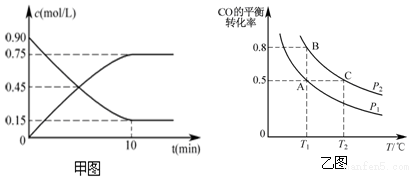
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线.
由图1判断,反应进行至t2时,曲线发生变化的原因是对平衡体系降温,平衡正向移动,CO2浓度增大,O2浓度减小(用文字表达);
由图2判断,t2到t3的曲线变化的原因可能是b(填写序号).
a.升高温度 b.加了催化剂 c.通入O2 d.缩小容器体积

(3)工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
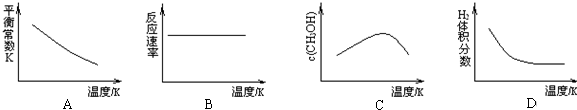
①已知该反应能自发进行,则下列(A-D)图象正确的是AC
②在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考查温度对反应的影响,实验结果如图3所示(注:T1、T2均大于300℃);下列说法正确的是CD(填序号)
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率:v(CH3OH)=$\frac{{n}_{A}}{{t}_{A}}$mol•L-1•min-1
B.该反应在T1时的平衡常数比T2时的小
C.该反应为放热反应
D.处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大
③在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,CO2转化率为a,则容器内的压强与起始压强之比为1-$\frac{a}{2}$.
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)图1中t2时改变条件瞬间,CO2、O2浓度不变,不能是改变浓度或改变压强,而后平衡正向移动,正反应为放热反应,降低温度平衡正向移动;
图2中t2到t3的曲线变化说明平衡没有移动,只是反应速率加快,正反应为气体体积增大的放热反应,应是使用催化剂;
(3)①反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)是熵减小的反应,△H-T△S<0能够自发进行,则正反应为放热反应,平衡后升高温度平衡逆向移动,平衡常数减小、反应速率增大、甲醇的浓度减小、氢气体积分数增大,未到平衡前,随温度升高甲醇的浓度增大、氢气体积分数减小;
②由图可知,T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2?CH3OH+H2O向逆反应方向移动,故正反应为放热反应,则T1时的平衡常数比T2时的大,故反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大,①中按照其计算速率的方法可知反应速率的单位错误,应为mol•min-1;
③根据二氧化碳的转化率计算平衡时各物质的物质的量,恒温恒容下,压强之比对气体物质的量之比.
解答 解:(1)4FeO+Cr2O3(s)+8Na2CO3(s)+7O2?8Na2CrO4(s)+2Fe2O3(s)+8CO2的化学平衡常数表达式K=$\frac{{c}^{8}(C{O}_{2})}{{c}^{7}({O}_{2})}$,故答案为:$\frac{{c}^{8}(C{O}_{2})}{{c}^{7}({O}_{2})}$;
(2)图1中t2时改变条件瞬间,CO2、O2浓度不变,不能是改变浓度或改变压强,而后平衡正向移动,正反应为放热反应,降低温度平衡正向移动;
图2中t2到t3的曲线变化说明平衡没有移动,只是反应速率加快,正反应为气体体积增大的放热反应,应是使用催化剂,
故答案为:对平衡体系降温,平衡正向移动,CO2浓度增大,O2浓度减小;b;
(3)①反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)是熵减小的反应,△H-T△S<0能够自发进行,则正反应为放热反应.
A.升温平衡逆向移动,平衡常数随温度的升高而减小,故A正确;
B.升温化学反应速率加快,故B错误;
C.达平衡后再升温,平衡逆向移动,甲醇浓度减小,故C正确;
D.达平衡后再升温,平衡逆向移动,氢气体积分数增大,故D错误;
故答案为:AC;
②A.按照其计算速率的方法可知反应速率的单位错误,应为mol•min-1,一般用单位时间内浓度变化量表示反应速率,故A错误;
B.由图可知,T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2?CH3OH+H2O向逆反应方向移动,则T1时的平衡常数比T2时的大,故B错误;
C.升高温度,平衡逆向移动,故正反应为放热反应,故C正确;
D.反应体系从T1变到T2,平衡逆向移动,则达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大,故D正确;
故答案为:CD;
③反应达到平衡后,若CO2转化率为a,则:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol):1 3 0 0
转化(mol):a 3a a a
平衡(mol):1-a 3-3a a a
根据相同条件下气体的压强之比等于物质的量之比,即(1-a+3-3a+a+a):(1+3)=1-$\frac{a}{2}$,
故答案为:1-$\frac{a}{2}$.
点评 本题考查化学平衡的计算,为高频考点,把握图象分析、平衡移动、化学平衡三段法为解答的关键,侧重分析与及计算能力的考查,注意图象与平衡移动原理的结合,题目难度不大.

(一)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度
B.移出部分CO2
C.加入合适的催化剂
D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.006 mol•L-1•min-1.
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是KClO;生成0.5mol K2FeO4转移电子的物质的量是1.5mol.
查阅资料得到以下有关高氯酸的信息:
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |
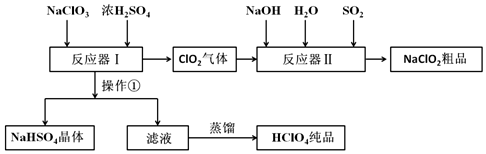
(1)操作①的名称是过滤.
(2))Ca(ClO)2、ClO2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有强氧化性
(3)反应器Ⅰ中投料时需加入过量浓硫酸,请简述目的为了产物能得到HClO4而不是NaClO4.
(4)反应器Ⅱ中发生反应的离子方程式为4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O.
(5)某学习小组模拟工业流程图中的蒸馏过程,有液体流出时立即收集产品以获得HClO4纯品.请评价这一操作是否合理并说明理由不合理,因为水的沸点是100℃,HClO4的沸点是130℃,所以最先蒸馏流出的是水而不是HClO4.
| A. | amol-1 | B. | 2amol-1 | C. | 4amol-1 | D. | 8a mol-1 |
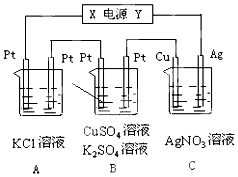 如图所示,溶液体积均为200mL,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,溶液体积均为200mL,若电解5min时铜电极质量增加2.16g,试回答: CO2与H2合成甲醚的主要反应如下:
CO2与H2合成甲醚的主要反应如下: