��Ŀ����
14��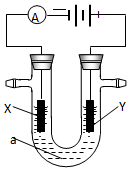 �� 1 ����ҵ��ͨ����ⱥ���Ȼ�����Һ�ķ�������������ƣ��ҹ����ȼҵ���������ӽ���Ĥ���ۣ�д����ⱥ���Ȼ�����Һʱ�ĵ缫��Ӧ���ܵ����ӷ�Ӧ����ʽ��
�� 1 ����ҵ��ͨ����ⱥ���Ȼ�����Һ�ķ�������������ƣ��ҹ����ȼҵ���������ӽ���Ĥ���ۣ�д����ⱥ���Ȼ�����Һʱ�ĵ缫��Ӧ���ܵ����ӷ�Ӧ����ʽ��X����2H++2e-=H2����
Y����2Cl--2e-=Cl2����
�ܵ����ӷ�Ӧʽ��2Cl-+2H2O=Cl2��+H2��+2OH-��
��2����Ҫ�õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ����X�缫�IJ����Ǵ�ͭ��Y�缫�IJ����Ǵ�ͭ��Y�缫��ӦʽΪCu-2e-=Cu2+��
���� ��1���õ�����X��������Y����������ⱥ���Ȼ�����Һʱ��X�缫�������ӷŵ�����������Y�缫�������ӷŵ�����������ͬʱ��������������NaOH��
��2����⾫����ͭʱ����ͭ����������ͭ��������������Cuʧ���ӷ���������Ӧ��
��� �⣺��1���õ�����X��������Y����������ⱥ���Ȼ�����Һʱ��X�缫�������ӷŵ�����������Y�缫�������ӷŵ�����������ͬʱ��������������NaOH������������������ط�Ӧʽ�ֱ�Ϊ2 H++2 e-=H2����2 Cl--2 e-=Cl2����2 Cl-+2 H2O=Cl2��+H2��+2OH-��
�ʴ�Ϊ��2 H++2 e-=H2����2 Cl--2 e-=Cl2����2 Cl-+2 H2O=Cl2��+H2��+2OH-��
��2����⾫����ͭʱ����ͭ����������ͭ��������������Cuʧ���ӷ���������Ӧ����XΪ��ͭ��YΪ��ͭ�������缫��ӦʽΪCu-2 e-=Cu2+��
�ʴ�Ϊ����ͭ����ͭ��Cu-2 e-=Cu2+��
���� ���⿼����ԭ����Ϊ��Ƶ���㣬���ؿ���ѧ�������жϼ��缫��Ӧʽ����д����ȷ���ԭ���ǽⱾ��ؼ���֪�������缫�Ϸ����ķ�Ӧ����Ŀ�ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
4�������仯�������������������й㷺Ӧ�ã���ش��������⣺
��һ����¯���������з�������Ҫ��ӦΪ��$\frac{1}{3}$Fe2O3��s��+CO��g��?$\frac{2}{3}$Fe��s��+CO2��g��
��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
��1���÷�Ӧ��ƽ�ⳣ������ʽK=$\frac{c��C{O}_{2}��}{c��CO��}$����H��0�����������������=������
��2�������������Ӧ��CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��B��
A����߷�Ӧ�¶�
B���Ƴ�����CO2
C��������ʵĴ���
D����С�������ݻ�
��3����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����ʱ���������������������������=����������10min����1000��ﵽƽ�⣬���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ���ʦԣ�CO2��=0.006 mol•L-1•min-1��
������������أ�K2FeO4����һ�ּ�������������������һ������Ͷ��ˮ��������
��4��һ��������Fe��OH��3��KClO��KOH��Һ�з�Ӧ���Ƶ�K2FeO4�����з�Ӧ����������KClO������0.5mol K2FeO4ת�Ƶ��ӵ����ʵ�����1.5mol��
��һ����¯���������з�������Ҫ��ӦΪ��$\frac{1}{3}$Fe2O3��s��+CO��g��?$\frac{2}{3}$Fe��s��+CO2��g��
��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
| �¶�/�� | 1000 | 1115 | 1300 |
| ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
��2�������������Ӧ��CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��B��
A����߷�Ӧ�¶�
B���Ƴ�����CO2
C��������ʵĴ���
D����С�������ݻ�
��3����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����ʱ���������������������������=����������10min����1000��ﵽƽ�⣬���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ���ʦԣ�CO2��=0.006 mol•L-1•min-1��
������������أ�K2FeO4����һ�ּ�������������������һ������Ͷ��ˮ��������
��4��һ��������Fe��OH��3��KClO��KOH��Һ�з�Ӧ���Ƶ�K2FeO4�����з�Ӧ����������KClO������0.5mol K2FeO4ת�Ƶ��ӵ����ʵ�����1.5mol��
5���ڱ�״���£����2.8L��������a����ԭ�ӣ����ӵ������ɱ�ʾΪ��������
| A�� | amol-1 | B�� | 2amol-1 | C�� | 4amol-1 | D�� | 8a mol-1 |
2����NA��ʾ�����ӵ�����������˵���У���ȷ���ǣ�������
| A�� | 1molþԭ���к��еĵ�����Ϊ2NA | |
| B�� | ��0�棬101 kPaʱ��22.4 L�����к���NA����ԭ�� | |
| C�� | 25�棬1.01��105Pa��64 g SO2�к��е�ԭ����Ϊ3NA | |
| D�� | NA��һ����̼���Ӻ�0.5 mol�����������Ϊ7��4 |
4���о���ѧ��Ӧ����188O��Ϊʾ��ԭ�ӣ���ԭ�ӵ��������ǣ�������
| A�� | 18 | B�� | 8 | C�� | 10 | D�� | 16 |