题目内容
20.在一定温度下,某容器内M、N两种物质,其物质的量随时间变化的曲线如图,下列表述中正确的是( )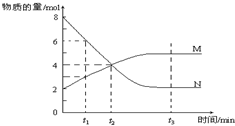
| A. | 该反应的化学方程式为:2 M?N | |
| B. | t1时,V正>V逆 | |
| C. | t2时,V正=V逆,达到平衡 | |
| D. | t 3时,M、N的浓度不再发生变化,反应停止 |
分析 A.根据图象判断出反应物和生成物,根据物质的量的变化判断计量数之间的关系;
B.根据反应进行的方向判断;
C.根据各组分的浓度是否不再变化判断平衡状态;
D.根据某一时间反应中各物质的物质的量是否变化判断反应是否达到平衡.
解答 解:A.由图象可知,反应中M的物质的量逐渐增多,N的物质的量逐渐减少,则在反应中N为反应物,M为生成物,图象中,在相等的时间内消耗的N和M的物质的之比为2:1,所以反应方程式应为:2N?M,故A错误;
B.t1时,N物质的量降低,M物质的量增大,化学平衡向正反应方向移动,则V正>V逆,故B正确;
C.由图可知t2时,此时反应继续向正方向移动,正反应速率大于逆反应速率,反应没有达到平衡,故C错误;
D.由图可知t3时,各组分的浓度不再变化,反应达到平衡状态,反应还在进行,不过正逆反应速率相等,而非停止,故D错误;
故选B.
点评 本题考查化学化学平衡的计算,题目难度中等,做题时注意从反应物和生成物的物质的量的变化角度,正确判断反应物和生成物以及反应是否达到平衡为解答关键,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
10.纳米碳是“纳米材料”中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的分散系①是浊液 ②是胶体 ③静置后析出黑色碳粒 ④能产生丁达尔效应.判断正确的是( )
| A. | ①②④ | B. | ②③④ | C. | ②④ | D. | ①③④ |
11.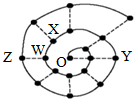 某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )
 某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )| A. | 物质YO可能具有较强的氧化性 | |
| B. | 图中离O点越远的元素,其原子半径一定越大 | |
| C. | O2X、WO3分子内都含有氢键,所以沸点都较高 | |
| D. | 科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的Z元素 |
8.下列方法能用来验证Fe3+的是( )
①溶液呈浅绿色 ②与碱反应生成红褐色沉淀 ③Fe3+既具有氧化性,又具有还原性 ④Fe3+的水溶液滴入KSCN试液后,立即出现红色.
①溶液呈浅绿色 ②与碱反应生成红褐色沉淀 ③Fe3+既具有氧化性,又具有还原性 ④Fe3+的水溶液滴入KSCN试液后,立即出现红色.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
15.下列有关热化学方程式的叙述正确的是( )
| A. | 2H2(g)+O2(g)═2H2O(g)△H=+483.6 kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol | |
| D. | 己知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
12.金属材料在日常生活以及生产中有着广泛的应用.下列关于金属的一些说法不正确的是( )
| A. | 金属钠保存在煤油中 | |
| B. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| C. | 合金的硬度一般比各成分金属大 | |
| D. | 铜与氯化铁溶液的反应常用于制作印刷电路板 |
9.2015年8月12日,天津滨海新区某公司仓库发生爆炸,事发仓库里存放了大量的硝酸铵( NH4NO3)、氰化钠(NaCN)、电石(CaC2)和金属钠等危险化学品.下列有关叙述不正确的是( )
| A. | 金属钠属于危化品中的易燃固体,其着火时不能用水灭火 | |
| B. | 氰化钠( NaCN)是一种剧毒危险品,其水溶液呈碱性 | |
| C. | 实验室里可将少量的钠保存于煤油中 | |
| D. | NH4N03、NaCN、CaC2中均含有离子键和非极性共价键 |
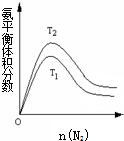 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为: