题目内容
10.2015年“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:(1)钠、钾着火,下列可用来灭火的是D.
A、水 B、泡沫灭火器 C、干粉灭火器 D、细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下受热分解,可发生不同的化学反应:
在110°C时:NH4NO3→NH3+HNO3+173kJ
在185~200°C时:NH4NO3→N2O+2H2O+127kJ
在230°C以上时,同时有弱光:2NH4NO3→2N2+O2+4H2O+129kJ,
在400°C以上时,发生爆炸:4NH4NO3→3N2+2NO2+8H2O+123kJ
上述反应过程中一定破坏了离子键、共价键化学键.
(3)NaCN的电子式为Na+[:C┇┇N:]-,Na+有10种运动状态不同的电子,C原子核外有3种能量不同的电子,N原子核外最外层电子排布有1对孤对电子.下列能说明碳与氮两元素非金属性相对强弱的是A.
A、相同条件下水溶液的pH:NaHCO3>NaNO3
B、酸性:HNO2>H2CO3
C、CH4比NH3更稳定
D、C 与H2的化合比N2与H2的化合更容易
(4)NaCN属于剧毒物质,可以用双氧水进行无害化处理NaCN+H2O2--N2↑+X+H2O,试推测X的化学式为NaHCO3,
(5)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等. 写出CNO-在酸性条件下被NaClO氧化的离子方程式:2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O.
分析 (1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧;
(2)氯化铵属于离子化合物,含有离子键和共价键;
(3)NaCN属于离子化合物,C、N原子周围都是8个电子;Na+原子核外有10个电子;根据C的电子排布判断;N的原子核有7个电子,最外层有5个;比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱;
(4)根据元素守恒确定X中元素,根据转移电子守恒、原子守恒确定X化学式;
(5)根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,根据氧化还原反应配平.
解答 解:(1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧,所以应该采用细沙灭火,
故答案为:D;
(2)氯化铵属于离子化合物,含有离子键和共价键,氯化铵分解时破坏了共价键和离子键;
故答案为:离子键、共价键;
(3)NaCN属于离子化合物,C、N原子周围都是8个电子,其电子式为:Na+[:C┇┇N:]-;Na+原子核外有10个电子,每个电子一种运动状态,共10种运动状态不同的电子;C的电子排布式为1s22s22p2,共有3种能量不同的电子;N的原子核有7个电子,最外层有5个,根据其电子式可知,含有1个孤电子对;
A.相同条件下水溶液的pH:NaHCO3>NaNO3,说明硝酸的酸性强于碳酸,则证明非金属性N>C,故A正确;
B.酸性:HNO2>H2CO3,由于亚硝酸不是N元素的最高价氧化物对应的水化物,无法比较二者的非金属性大小,故B错误;
C、CH4的稳定性比NH3弱,与实际不符,故C错误;
D、C 与H2的化合比N2与H2的化合更困难,与实际不符,故D错误;
故答案为:Na+[:C┇┇N:]-;10;3;1;A;
(4)根据元素守恒知,X中含有Na、C元素,该反应中N元素化合价由-3价转化为0价、NaCN中C元素化合价为+2价,则C元素化合价由+2价转化为+4价,转移电子数为6,根据转移电子守恒、原子守恒知X为NaHCO3,
故答案为:NaHCO3;
(5)根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
故答案为:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O..
点评 本题考查了元素化合物的性质、电子式、化学键、非金属性强弱比较、氧化还原反应等,侧重于考查学生的对基础知识的应用能力,注意把握元素化合物的性质以及反应中元素的化合价变化为解答的关键,题目难度中等.

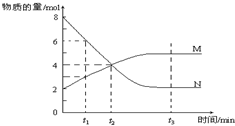
| A. | 该反应的化学方程式为:2 M?N | |
| B. | t1时,V正>V逆 | |
| C. | t2时,V正=V逆,达到平衡 | |
| D. | t 3时,M、N的浓度不再发生变化,反应停止 |
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物的水化物的酸性:Y>Z | |
| C. | 化合物WZ2中各原子均满足8电子的稳定结构 | |
| D. | Y、Z均能与碳元素形成共价化合物 |
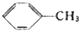 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$ $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$
(一)制备苯甲酸
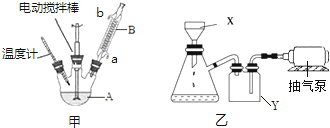
如甲图所示组装反应装置(部分装置未画出),向A中依次加入100mL水、8.5g高锰酸钾、2.7mL甲苯.相关数据如下表:
| 名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 92 | 无色液体、易燃、易挥发 | -95 | 110.6 | 不溶 | 互溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 112.4(100℃升华) | 248 | 微溶 | 易溶 |
(二)分离提纯
停止加热后,按如下流程分离出苯甲酸和回收未反应的甲苯:
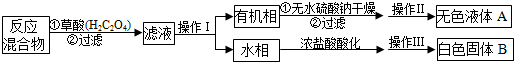
(2)操作I的名称是分液,操作Ⅱ时,应将有机相盛放在蒸馏烧瓶(填仪器名称)中.
(3)操作Ⅲ包括蒸发浓缩、冷却结晶、抽滤.抽滤装置为上图中的乙装置,将物质放在X装置(布氏漏斗)中,打开抽气泵,一段时间后X装置中剩余的是白色固体B,抽滤装置可以加快过滤速率,其工作原理是抽出装置中的空气,形成压强差,使过滤加快.
(三)提纯和纯度的测定
(4)为了进一步提纯苯甲酸,最好采用的方法是B(填编号).
A.溶于水后再过滤 B.加热升华 C.用乙醇洗涤 D.用甲苯萃取后再分液
(5)称取1.00g样品,加0.50mol/L的NaOH溶液,恰好完全反应时,消耗NaOH 溶液的体积为16.00mL,则产品的纯度为97.6%.
(四)性质验证
(6)设计实验证明苯甲酸是一种比碳酸酸性强的弱酸,简要说明实验操作,现象 和结论.
供选择的试剂:苯甲酸、苯甲酸钾溶液、饱和碳酸钠溶液、氢氧化钠溶液、稀盐酸、酚酞试液、石蕊试液.
| A | B | C | D |
 |  |  | 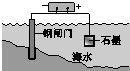 |
| 钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸 性较强,发生析氢 腐蚀 | 将锌板换成铜板对 钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 砷元素的最高化合价为+3 | B. | 砷元素是第四周期的主族元素 | ||
| C. | 砷原子的次外层上有8个电子 | D. | 砷的氧化物的水化物是强酸 |
| A. | 与H2化合时,X单质比Y单质容易 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | X原子的原子序数比Y原子的原子序数大 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
H2SO3+I2+H2O═2HI+H2SO4;2FeCl3+2HI═2FeCl2+2HCl+I2.
| A. | FeCl2>HI>H2SO3 | B. | HI>FeCl2>H2SO3 | C. | H2SO3>HI>FeCl2 | D. | FeCl2>H2SO3>HI |

| A. | 电路中电子流向为a→d→c→b | |
| B. | 电极b为负极,电极反应式为O2+4e一=2O2- | |
| C. | 电解后烧杯中溶液pH增大 | |
| D. | 理论上b极消耗气体和c极生成气体质量相等 |