题目内容
11. 某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )| A. | 物质YO可能具有较强的氧化性 | |
| B. | 图中离O点越远的元素,其原子半径一定越大 | |
| C. | O2X、WO3分子内都含有氢键,所以沸点都较高 | |
| D. | 科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的Z元素 |
分析 O点代表氢元素,按照原子序数由小到大由里往外延伸,由图可知,W为N元素,X为O元素,Y为Na元素,Z为P元素,根据元素的种类可知虚线相连的元素处于同一族.
A.NaH具有较强的还原性;
B.随原子序数增大距离O的距离增大,而同周期主族元素,随原子序数增大原子半径减小;
C.H2O、NH3分子间都含有氢键,分子内为共价键;
D.As与N元素处于同主族,性质具有相似性.
解答 解:O点代表氢元素,按照原子序数由小到大由里往外延伸,由图可知,W为N元素,X为O元素,Y为Na元素,Z为P元素,根据元素的种类可知虚线相连的元素处于同一族.
A.NaH中氢元素为-1价,具有较强的还原性,故A错误;
B.随原子序数增大距离O的距离增大,而同周期主族元素,随原子序数增大原子半径减小,图中离O点越远的元素,其原子半径不一定越大,故B错误;
C.H2O、NH3分子间都含有氢键,所以沸点都较高,而分子内为共价键,故C错误;
D.As与N元素处于同主族,性质具有相似性,该As元素最有可能取代了普通DNA链中的Z元素,故D正确.
故选:D.
点评 本题考查元素周期表与元素周期律、化学键等,难度不大,看懂图象推断元素是解题的关键,注意对元素周期表的整体把握.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目
1.质量百分含量为25%的氨水用等体积的水稀释后,所得溶液的溶质质量分数( )
| A. | 等于12.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
2.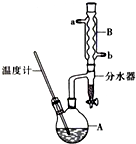 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:
反应物和产物的相关数据如下
合成正丁醚的步骤:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加正丁醇,再加浓H2SO4或将浓H2SO4滴加到正丁醇中.
写出步骤②中制备正丁醚的化学方程式2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为:正丁醇,下层液体的主要成分为水.(填物质名称)
(7)本实验中,正丁醚的产率为33.85%.
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
| 相对分子质量 | 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加正丁醇,再加浓H2SO4或将浓H2SO4滴加到正丁醇中.
写出步骤②中制备正丁醚的化学方程式2CH3CH2CH2CH2OH
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为:正丁醇,下层液体的主要成分为水.(填物质名称)
(7)本实验中,正丁醚的产率为33.85%.
16.“当好东道主,喜迎G20”,目前杭州为迎接即将到来的G20峰会,大量引进新能源公交车,如图所示即为一辆正在充电的电动公交车.

已知钒电池是一种常用于纯电动公交车的电池,其原理是利用钒的不同价态之间的转化,例如某种电池的充电原理可表示为2H++V2++VO2+═2V3++H2O,则下列说法不正确的是( )

已知钒电池是一种常用于纯电动公交车的电池,其原理是利用钒的不同价态之间的转化,例如某种电池的充电原理可表示为2H++V2++VO2+═2V3++H2O,则下列说法不正确的是( )
| A. | 阴极反应可表示为 2H++VO2++e-═V3++H2O | |
| B. | 阳极反应可表示为 V2+-e-═V3+ | |
| C. | 若阴极电解液体积为1L,电解前pH=1,当测得V3+的物质的量浓度为0.045mol/L时,pH变为2(不考虑反应过程中体积变化) | |
| D. | 放电过程种负极反应可表示为V3++2OH--e-═VO2++H2O |
3.现有MgCl2、AlCl3、CuCl2、FeCl3、FeCl2、NH4Cl六种溶液,如果只用一种试剂把它们区分开来,这种试剂是( )
| A. | 氨水 | B. | AgNO3 | C. | NaOH | D. | BaCl2 |
20.在一定温度下,某容器内M、N两种物质,其物质的量随时间变化的曲线如图,下列表述中正确的是( )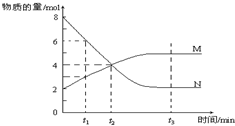

| A. | 该反应的化学方程式为:2 M?N | |
| B. | t1时,V正>V逆 | |
| C. | t2时,V正=V逆,达到平衡 | |
| D. | t 3时,M、N的浓度不再发生变化,反应停止 |
1.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且互不同族,其中只有两种为金属元素,W原子的最外层电子数与次外层电子数相等,W与Z、X与Y这两对原子的最外层电子数之和均为9,单质X与Z都可与NaOH溶液反应.下列说法正确的是( )
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物的水化物的酸性:Y>Z | |
| C. | 化合物WZ2中各原子均满足8电子的稳定结构 | |
| D. | Y、Z均能与碳元素形成共价化合物 |
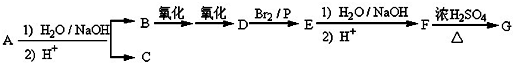

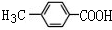 .
.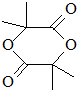 .
.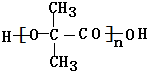 +(n-1)H2O,该反应属于缩聚反应(填反应类型).
+(n-1)H2O,该反应属于缩聚反应(填反应类型).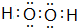 ,其中中心原子的杂化方式为sp3.
,其中中心原子的杂化方式为sp3.