题目内容
5.表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp).表1
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 6.2×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1.1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 9.1×10-6 |
| CaCO3 | 2.8×10-9 |
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是AB(填序号).
A.加少量CaCO3固体 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸 E.升高温度
(2)CH3COONH4的水溶液呈中性(选填“酸性”、“中性”、“碱性”).
(3)现将CaSO4转化为CaCO3.具体做法是用饱和的纯碱溶液浸泡CaSO4粉末,并不断补充纯碱,最后CaSO4转化为CaCO3.现有足量的CaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-)达到0.0l mol/L以上,则溶液中c(CO32-)应不低于0.236mol/L.(计算结果保留3位有效数字)
分析 (1)根据弱电解质电离平衡移动的影响因素来回答,电离平衡常数只与温度有关;
(2)CH3COONH4的醋酸根离子和铵根离子水解程度一样来确定溶液的酸碱性;
(3)可以根据硫酸钡、碳酸钡的溶解度计算出使SO42-物质的量浓度不小于0.01mol•L-1,求出溶液中CO32-物质的量浓度.
解答 解:(1)根据醋酸的电离平衡:CH3COOH?CH3COO-+H+,
A.加少量CaCO3固体,消耗氢离子,电离程度增大,电离平衡常数不变,故A正确;
B.加水稀释,电离程度增大,电离平衡常数不变,故B正确;
C.加少量的CH3COONa固体,电离出的醋酸根对醋酸的电离平衡起抑制作用,电离程度减小,电离平衡常数不变,故C错误;
D.加少量冰醋酸,则醋酸浓度增大,根据越稀越电离的事实,则电离程度减小,平衡常数不变,故D错误;
E.升高温度,电离程度增大,电离平衡常数增大,故E错误;
故答案为:AB;
(2)醋酸铵溶液中,醋酸水解显碱性,铵根离子水解显酸性,CH3COOH与NH3•H2O的电离平衡常数相等,CH3COO-和NH4+在相等浓度时的水解程度相同,酸性和碱性程度相当,溶液显中性,;
故答案为:中性;
(3)SO42-物质的量浓度为0.01mol•L-1时,钡离子的浓度为:c(Ba2+)=$\frac{1.1×1{0}^{-10}}{0.01}$mol/L=1.1×10-8mol/L,若使SO42-物质的量浓度不小于0.01mol•L-1,则钡离子浓度应该大于1.1×10-8mol/L;当钡离子浓度为1.1×10-8mol/L时,则溶液中碳酸根离子浓度为:$\frac{2.6×1{0}^{-9}}{1.1×1{0}^{-8}}$mol/L=0.236mol/L,所以当碳酸根离子浓度≥0.236mol/L时,钡离子浓度小于1.1×10-8mol/L,则SO42-物质的量浓度不小于0.01mol/L,
故答案为:0.236.
点评 本题考查了弱电解质的电离平衡、难溶物的溶解平衡及沉淀转化本质,题目难度中等,明确电离平衡常数的含义是解本题的关键,(3)为难点、易错点,注意合理分析、处理题中信息.

| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 235U中的235表示该原子的相对原子质量 | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 丙烷分子的比例模型: | |
| D. | 第三周期简单阴离子结构示意图均可表示为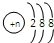 |
①SiO2→Na2SiO3 ②Fe(OH)2→Fe(OH)3 ③SiO2→H2SiO3
④Al2O3→Al(OH)3 ⑤Ca(OH)2→NaOH ⑥NaAlO2→AlCl3.
| A. | ①② | B. | ③④ | C. | ③④⑤ | D. | ⑤⑥ |
| A. | CH3-CH=CH-CHO | B. | CH3-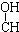 - -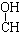 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-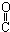 -CH2-CHO -CH2-CHO |
| 选项 | 实验目的 | 实验设计 |
| A | 制备Fe(OH)3胶体 | 向0.1mol•L-1的FeCl3溶液中加入等体积0.3mol•L-1的NaOH溶液,煮沸 |
| B | 除去CO2中的HCl | 将混合气体依次通入Na2CO3溶液和浓硫酸中 |
| C | 检验溶液中是否含有SO42- | 取少量待检测溶液,向其中加入Ba(NO3)2溶液,再加入少量盐酸,观察实验现象 |
| D | 验证氧化性:Fe3+<Br2<Cl2 | 向试管中依次加入1mL0.1mol•L-1FeBr2溶液,几滴KSCN溶液和1mL苯,然后逐滴加入氯水,轻轻振荡,观察整个过程中有机相和水相中的现象 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 分子间作用力,离子键 | B. | 化学键,分子间作用力 | ||
| C. | 化学键,化学键 | D. | 分子间作用力,分子间作用力 |
 ;
;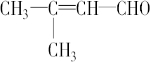 .
.