题目内容
13.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )| A. | 235U中的235表示该原子的相对原子质量 | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 丙烷分子的比例模型: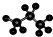 | |
| D. | 第三周期简单阴离子结构示意图均可表示为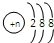 |
分析 A.元素符号的左上角数字代表质量数;
B.次氯酸的中心原子是氧原子;
C.球棍模型展示原子相对大小和成键情况;
D.第三周期元素的简单阴离子都是3个电子层.
解答 解:A.235U中的235表示该原子的质量数,故A错误;
B.次氯酸的结构式为:H-O-Cl,故B错误;
C.图为丙烷的球棍模型,不是比例模型,故C错误;
D.第三周期元素的简单阴离子都是3个电子层,阴离子结构示意图均可表示为 ,故D正确;
,故D正确;
故选D.
点评 本题考查物质结构和化学用语,侧重于基础知识的考查,题目难度不大,注意基础知识的积累.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
1.A、B、C、D、E是同周期元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中离子半径最小的,则它们的原子序数由小到大的顺序是( )
| A. | E、C、D、B、A | B. | B、A、E、D、C | C. | E、B、A、D、C | D. | A、B、C、D、E |
8.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | X | Y | Z | W | Q |
| 原子半径/pm | 160 | 143 | 70 | 66 | 102 |
| 主要化合价 | +2 | +3 | +5、-3 | -2 | +6、-2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 氢化物的沸点 H2W>H2Q |
18.用惰性电极和相同电量分别电解①HCl ②KNO3 ③CuCl2 ④CuSO4四种电解质溶液,在理论上生成气体的总体积(同温同压下)由多到少的顺序是( )
| A. | ④③②① | B. | ①②③④ | C. | ④②①③ | D. | ③④①② |
5.表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp).
表1
表2
请回答下面问题:
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是AB(填序号).
A.加少量CaCO3固体 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸 E.升高温度
(2)CH3COONH4的水溶液呈中性(选填“酸性”、“中性”、“碱性”).
(3)现将CaSO4转化为CaCO3.具体做法是用饱和的纯碱溶液浸泡CaSO4粉末,并不断补充纯碱,最后CaSO4转化为CaCO3.现有足量的CaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-)达到0.0l mol/L以上,则溶液中c(CO32-)应不低于0.236mol/L.(计算结果保留3位有效数字)
表1
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 6.2×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1.1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 9.1×10-6 |
| CaCO3 | 2.8×10-9 |
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是AB(填序号).
A.加少量CaCO3固体 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸 E.升高温度
(2)CH3COONH4的水溶液呈中性(选填“酸性”、“中性”、“碱性”).
(3)现将CaSO4转化为CaCO3.具体做法是用饱和的纯碱溶液浸泡CaSO4粉末,并不断补充纯碱,最后CaSO4转化为CaCO3.现有足量的CaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-)达到0.0l mol/L以上,则溶液中c(CO32-)应不低于0.236mol/L.(计算结果保留3位有效数字)

 .
.