题目内容
10.铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等.回答下列问题:(1)PbO2的酸性比CO2的酸性弱(填“强”或“弱”).
(2)Sn和Pb位于同一主族,同条件下Pb与同浓度稀盐酸却比Sn慢,猜测理由PbC12微溶于水,覆盖在Pb的表面,速度减慢或终止.
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为PbO+ClO-=PbO2+Cl-.
(4)铅蓄电池是最常兄的二次电池,其构造示意图如图1.
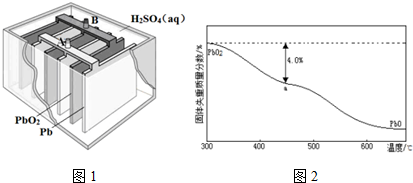
放电时的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(1)
正极反应式是PbO2+4H++SO42-+2e-=PbSO4+2H2O,一段时间后,负极增重48克,转移电子1mol
(5)PbO2在加热过程发生分解的失重曲线如图2所示,己知失重曲线上的a点为样品失重4.0%(即$\frac{样品起始质量-a点固体质量}{样品起始质量}$×100%)的残留固体,若a点固体表示为PbOx或mPbO2•nPbO,列式计算x1.4值和m:n值2:3.
分析 (1)元素非金属性越强,其最高价氧化物的水化物酸性越强;
(2)PbC12微溶于水,覆盖在Pb的表面;
(3)PbO和次氯酸钠反应生成二氧化铅和氯化钠;
(4)正极发生还原反应,反应式是PbO2+4H++SO42-+2e-=PbSO4+2H2O;段时间后,负极增重48克,$\frac{48}{96}$=0.5mol,所以转移电子2×0.5mol=1mol;
(5)样品失重失去的为氧元素,根据原子守恒求O原子和Pb原子的比值.
解答 解:(1)元素非金属性越强,其最高价氧化物的水化物酸性越强,非金属性C>Pb,所以元素最高价氧化物的水化物酸性Pb的比C的酸性弱,故答案为:弱;
(2)PbC12微溶于水,覆盖在Pb的表面,隔绝铅与浓盐酸的接触,所以同条件下Pb与同浓度稀盐酸却比Sn慢,故答案为:PbC12微溶于水,覆盖在Pb的表面,速度减慢或终止;
(3)PbO和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为PbO+ClO-=PbO2+Cl-,故答案为:PbO+ClO-=PbO2+Cl-;
(4)正极发生还原反应,反应式是PbO2+4H++SO42-+2e-=PbSO4+2H2O;段时间后,负极增重48克,$\frac{48}{96}$=0.5mol,所以转移电子2×0.5mol=1mol,故答案为:PbO2+4H++SO42-+2e-=PbSO4+2H2O;1;
(5)若a点固体组成表示为PbOx,根据PbO2$\frac{\underline{\;\;△\;\;}}{\;}$PbOx+$\frac{2-x}{2}$O2↑,
$\frac{2-x}{2}$×32=239×4.0%,x=1.4;
若组成为mPbO2•nPbO,根据原子守恒得,O原子和Pb原子的比值=$\frac{2m+n}{m+n}$=1.4,得m:n=2:3,
故答案为:1.4;2:3.
点评 本题考查碳族元素性质,题目难度中等,涉及物质的量的有关计算、离子反应、电解原理等知识点,注意(4)中阳极、阴极电极反应式的书写,注意(5)中的计算,为易错点.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案表1
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 6.2×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1.1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 9.1×10-6 |
| CaCO3 | 2.8×10-9 |
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是AB(填序号).
A.加少量CaCO3固体 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸 E.升高温度
(2)CH3COONH4的水溶液呈中性(选填“酸性”、“中性”、“碱性”).
(3)现将CaSO4转化为CaCO3.具体做法是用饱和的纯碱溶液浸泡CaSO4粉末,并不断补充纯碱,最后CaSO4转化为CaCO3.现有足量的CaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-)达到0.0l mol/L以上,则溶液中c(CO32-)应不低于0.236mol/L.(计算结果保留3位有效数字)
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
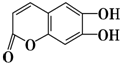 中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用.有机物M是中药狼把草的成分之一,其结构如图所示.下列叙述不正确的是( )
中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用.有机物M是中药狼把草的成分之一,其结构如图所示.下列叙述不正确的是( )| A. | M是芳香族化合物,它的分子式为C9H6O4 | |
| B. | 1 mol M最多能与3 mol Br2发生反应 | |
| C. | 1 mol M最多能与含有3 mol NaOH的溶液发生反应 | |
| D. | 在一定条件下能发生取代、加成、水解、氧化等反应 |

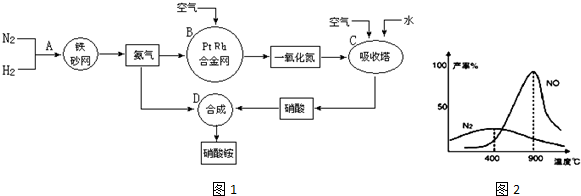
 4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.
4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.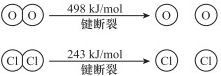
 .
.