题目内容
10.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是( )| A. | CH3-CH=CH-CHO | B. | CH3-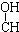 - -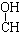 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-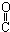 -CH2-CHO -CH2-CHO |
分析 含-OH、-COOH可发生酯化反应,含碳碳双键、-CHO可发生还原反应、加成反应,含-OH且与-OH相连C的邻位C上有H可发生消去反应,以此来解答.
解答 解:A.含碳碳双键、-CHO可发生还原反应、加成反应,不能发生酯化、消去反应,故A不选;
B.含-OH可发生酯化、消去反应,不能发生还原、加成反应,故B不选;
C.含-OH可发生酯化、消去反应,含-CHO可发生还原、加成反应,含有碳碳双键,可发生加成反应,故C选;
D.含-CHO可发生还原反应、加成反应,含-OH可发生酯化反应,但不能发生消去反应,故D不选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇、醛、烯烃性质的考查,选项D为解答的易错点,注意醇消去反应的结构特点,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
1.A、B、C、D、E是同周期元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中离子半径最小的,则它们的原子序数由小到大的顺序是( )
| A. | E、C、D、B、A | B. | B、A、E、D、C | C. | E、B、A、D、C | D. | A、B、C、D、E |
18.用惰性电极和相同电量分别电解①HCl ②KNO3 ③CuCl2 ④CuSO4四种电解质溶液,在理论上生成气体的总体积(同温同压下)由多到少的顺序是( )
| A. | ④③②① | B. | ①②③④ | C. | ④②①③ | D. | ③④①② |
5.表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp).
表1
表2
请回答下面问题:
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是AB(填序号).
A.加少量CaCO3固体 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸 E.升高温度
(2)CH3COONH4的水溶液呈中性(选填“酸性”、“中性”、“碱性”).
(3)现将CaSO4转化为CaCO3.具体做法是用饱和的纯碱溶液浸泡CaSO4粉末,并不断补充纯碱,最后CaSO4转化为CaCO3.现有足量的CaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-)达到0.0l mol/L以上,则溶液中c(CO32-)应不低于0.236mol/L.(计算结果保留3位有效数字)
表1
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 6.2×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1.1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 9.1×10-6 |
| CaCO3 | 2.8×10-9 |
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是AB(填序号).
A.加少量CaCO3固体 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸 E.升高温度
(2)CH3COONH4的水溶液呈中性(选填“酸性”、“中性”、“碱性”).
(3)现将CaSO4转化为CaCO3.具体做法是用饱和的纯碱溶液浸泡CaSO4粉末,并不断补充纯碱,最后CaSO4转化为CaCO3.现有足量的CaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-)达到0.0l mol/L以上,则溶液中c(CO32-)应不低于0.236mol/L.(计算结果保留3位有效数字)
15.部分氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,进行如下处理:
下列说法正确的是( )

下列说法正确的是( )
| A. | 滤液A中的阳离子为Fe2+、Fe3、H+ | B. | 样品中金属Fe的质量为4.48g | ||
| C. | 样品中CuO的质量为4.0 | D. | V=448 |
