题目内容
20.下列6个转化,其中不能通过一步反应实现的是( )①SiO2→Na2SiO3 ②Fe(OH)2→Fe(OH)3 ③SiO2→H2SiO3
④Al2O3→Al(OH)3 ⑤Ca(OH)2→NaOH ⑥NaAlO2→AlCl3.
| A. | ①② | B. | ③④ | C. | ③④⑤ | D. | ⑤⑥ |
分析 ①SiO2与氢氧化钠反应生成硅酸钠和水;
②Fe(OH)2与氧气、水反应生成Fe(OH)3;
③SiO2不溶于水,与水不反应;
④Al2O3不溶于水,与水不反应;
⑤Ca(OH)2→与碳酸钠反应生成碳酸钙和NaOH;
⑥NaAlO2与足量盐酸反应生成AlCl3和氯化钠、水;
解答 解:①SiO2与氢氧化钠反应生成硅酸钠和水,所以SiO2→Na2SiO3能够一步实现,故正确;
②Fe(OH)2与氧气、水反应生成Fe(OH)3,所以Fe(OH)2→Fe(OH)3 能够一步实现,故正确;
③SiO2不溶于水,与水不反应,所以SiO2→Na2SiO3不能够一步实现,故错误;
④Al2O3不溶于水,与水不反应,所以Al2O3→Al(OH)3不能够一步实现,故错误;
⑤Ca(OH)2→与碳酸钠反应生成碳酸钙和NaOH,所以Ca(OH)2→NaOH 能够一步实现,故正确;
⑥NaAlO2与足量盐酸反应生成AlCl3和氯化钠、水,所以NaAlO2→AlCl3能够一步实现,故正确;
故选:B.
点评 本题考查了物质相互之间的转化,明确物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
10.下列叙述中,正确的是( )
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程中镀层金属应该放在阳极.
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程中镀层金属应该放在阳极.
| A. | ①②③④ | B. | ③④ | C. | ③④⑤ | D. | ④ |
11.下列实验方案不能达到实验目的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| D | 验证苯和液溴在FeBr3的催化下发生取代反应 | 将反应产生的混合气体先通入溴的四氯化碳溶液再通入AgNO3溶液中,观察是否有淡黄色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
8.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | X | Y | Z | W | Q |
| 原子半径/pm | 160 | 143 | 70 | 66 | 102 |
| 主要化合价 | +2 | +3 | +5、-3 | -2 | +6、-2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 氢化物的沸点 H2W>H2Q |
15.以下说法正确的是( )
| A. | 物质中化学键破坏了,一定发生了化学变化 | |
| B. | 水的沸点比硫化氢高,是因为水中的化学键比硫化氢中的化学键强 | |
| C. | 第三周期元素的离子半径逐渐变小 | |
| D. | 共价化合物中一定存在化学键 |
5.表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp).
表1
表2
请回答下面问题:
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是AB(填序号).
A.加少量CaCO3固体 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸 E.升高温度
(2)CH3COONH4的水溶液呈中性(选填“酸性”、“中性”、“碱性”).
(3)现将CaSO4转化为CaCO3.具体做法是用饱和的纯碱溶液浸泡CaSO4粉末,并不断补充纯碱,最后CaSO4转化为CaCO3.现有足量的CaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-)达到0.0l mol/L以上,则溶液中c(CO32-)应不低于0.236mol/L.(计算结果保留3位有效数字)
表1
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 6.2×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1.1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 9.1×10-6 |
| CaCO3 | 2.8×10-9 |
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是AB(填序号).
A.加少量CaCO3固体 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸 E.升高温度
(2)CH3COONH4的水溶液呈中性(选填“酸性”、“中性”、“碱性”).
(3)现将CaSO4转化为CaCO3.具体做法是用饱和的纯碱溶液浸泡CaSO4粉末,并不断补充纯碱,最后CaSO4转化为CaCO3.现有足量的CaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-)达到0.0l mol/L以上,则溶液中c(CO32-)应不低于0.236mol/L.(计算结果保留3位有效数字)
12.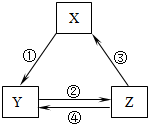 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Fe2O3 | FeCl3 | Fe(OH)3 | ③加入盐酸 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加入盐酸 |
| A. | A | B. | B | C. | C | D. | D |
6.下列说法不正确的是( )
| A. | 金刚石和石墨互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| D. | 分子式为C4H10的物质为纯净物 |
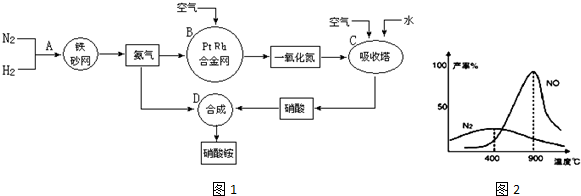
 4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.
4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.